Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема.
Химическая кинетика План лекции 1. Сущность химической кинетики. 2. Понятие скорости, молекулярности, порядка химической реакции, периода полупревращения вещества. 3. Кинетические уравнения реакций нулевого, первого, второго порядков. 4. Факторы, определяющие скорость химической реакции. 5. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье. 6. Химическое равновесие в гетерогенных системах. Правило фаз Гиббса.
Принципиальную возможность протекания той или иной химический реакции предсказывает химическая термодинамика (D G < 0). Однако далеко не все термодинамически возможные реакции осуществляются в действительности. Химическая кинетика устанавливает законы, определяющие скорость химических процессов, выясняет роль различных факторов, влияющих на скорость и определяющих механизмы реакций. Зная законы кинетики и механизмы реакций, можно управлять химическими процессами. От скорости химической реакции зависит выход продуктов, т. е. производительность труда и аппаратуры. Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема. В общем случае скорость химической реакции определяется как производная концентрации реагирующего вещества по времени при постоянном объеме системы: v = -dc/dt, (6.1) где v – скорость, выраженная убылью концентрации (с) реагирующего вещества; t – время. Если скорость химической реакции выразить через концентрацию одного из продуктов реакции (концентрация продуктов увеличивается), то v = dc/dt (6.2) Согласно закону действующих масс, скорость химической реакции a A + b B = c C определяется выражением v = kC A a C B b ,(6.3) где C А и С B – концентрации реагирующих веществ; k – константа скорости реакции. Это выражение называется основным постулатом химической кинетики. Физический смысл константы скорости k можно установить, если принять концентрации всех реагирующих веществ равными единице. Тогда, v = k, (6.4) т.е. константа скорости химической реакции – это скорость реакции при концентрациях реагирующих веществ, равных единице. Константа скорости, как и скорость, зависит от природы реагирующих веществ, температуры, наличия катализатора, но не зависит от концентрации. По известным величинам k сравнивают скорости различных реакций. Молекулярност ь химической реакции определяется числом молекул (частиц), участвующих в элементарном акте реакции. По молекулярности различают одномолекулярные, двухмолекулярные и трехмолекулярные реакции. Порядок реакции – сумма показателей степеней концентраций всех реагентов, входящих в уравнение скорости реакции. Реакции могут быть: первого порядка (v = kс); второго порядка (v = kс2), третьего порядка (v = kс3), а также нулевого и дробного порядка. Период полупревращения (период полураспада) реакции – время, необходимое для того, чтобы концентрация реагента стала равна половине исходного значения. Кинетическое уравнение выражает зависимость скорости химической реакции от концентраций компонентов реакционной смеси. Кинетическое уравнение для необратимой реакции нулевого порядка:
Период полупревращения для необратимой реакции нулевого порядка пропорционален начальному количеству вещества:
Кинетическое уравнение для необратимой реакции первого порядка:
Период полупревращения для необратимой реакции первого порядка, не зависит от начальной концентрации реагирующих веществ:
Кинетическое уравнение для необратимой реакции второго порядка:
Период полупревращения для необратимой реакции второго порядка обратно пропорционален начальной концентрации реагирующих веществ:
Зависимость скорости реакции от температуры. Ориентировочную зависимость скорости реакции от температуры определяет уравнение Вант-Гоффа:
где νt1 и νt2 - скорости химической реакции при температуре соответственно t1 и t2; γ – температурный коэффициент реакции. Из уравнения Вант-Гоффа вытекает связь константы скорости и температуры: повышение температуры на 10° (10 К) увеличивает константу скорости реакции в 2–4 раза:
Уравнение Аррениуса связывает константу скорости реакции с частотным фактором А, энергией активации Еа и температурой Т: k = Ae–Eа/RT или Катализ можно определить как изменение скорости химических реакций под влиянием веществ – катализаторов, многократно вступающих в промежуточное химическое взаимодействие с участниками реакции и восстанавливающих после каждого цикла промежуточных взаимодействий свой химический состав. В зависимости от агрегатного состояния участвующих в реакции веществ и катализатора различают гомогенный и гетерогенный катализ. Специфичность катализаторов заключается в том, что они проявляют активность лишь в отношении одной реакции или узкой группы реакций. Особенно специфично действие биологических катализаторов – ферментов. Ферменты катализируют превращения лишь отдельных химических соединений, даже если в реакционной смеси находится большое число сходных по строению изомеров данного вещества.
При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе – гомогенные реакции и в гетерогенной – гетерогенные реакции. Гомогенной называется система, состоящая из одной фазы (жидкость), гетерогенной – из двух и более. Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию, или образующегося при реакции за единицу времени в единице объема системы. Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице поверхности фазы. Рассматривая гетерогенные реакции, следует отметить, что их протекание связано с процессами переноса вещества. В ходе гетерогенной реакции можно выделить, по меньшей мере, три стадии: 1) Подвод реагирующего вещества к поверхности 2) Химическая реакция на поверхности 3) Отвод продукта реакции от поверхности. Скорость реакции будет определяться лимитирующей – самой медленной стадией. Если лимитирующими стадиями являются процессы подвода и отвода веществ, то для увеличения скорости реакции достаточно осуществлять постоянное перемешивание. Если лимитирующей стадией является собственно химическая реакция, то для ускорения процесса можно использовать катализаторы. К важнейшим факторам, влияющим на скорость реакции, относятся следующие: природа реагирующих веществ, их концентрации, температура, присутствие в системе катализаторов.
|

 , размерность k 0 [моль/(л×с)]. (6.5)
, размерность k 0 [моль/(л×с)]. (6.5) . (6.6)
. (6.6) 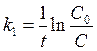 , размерность k 1 [с–1], [мин–1]. (6.7)
, размерность k 1 [с–1], [мин–1]. (6.7)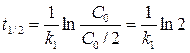 (6.8)
(6.8)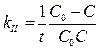 , размерность [л/(моль∙с)]. (6.9)
, размерность [л/(моль∙с)]. (6.9) (6.10)
(6.10)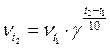 , (6.11)
, (6.11)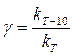 (6.12)
(6.12) (6.13)
(6.13)


