уравнений.
Когда отсутствуют сведения о теплотах образования соединений, то тепловой эффект реакций находят путём решения системы термохимических уравнений. С термохимическими уравнениями можно проводить любые операции как с алгебраическими уравнениями: 1) складывать, делить, умножать все члены уравнения на одно и то же число; 2) перемещать члены уравнения из одной части в другую; 3) менять все знаки на обратные перед всеми членами уравнения и т.д. При решении системы уравнений с целью нахождения нужного теплового эффекта поступают следующим образом: 1) Записывают уравнение с неизвестным тепловым эффектом. 2) Записывают уравнения с заданными эффектами, получая систему уравнений. 3) решают полученную систему уравнений таким образом, чтобы получить уравнение с неизвестным тепловым эффектом.
ПРИМЕР 1. Найти тепловой эффект реакции разложения карбоната натрия на основании реакций взаимодействия последнего и оксида натрия с оксидом кремния (4). Тепловой эффект первой реакции равен –819,0 кДж, а второй –243,0 кДж.
1. 2. Чтобы получить нужное уравнение реакции, надо из 1-го уравнения вычесть 2-ое.
Ответ: ЗАДАЧИ:
1. Определите теплоту образования СО2 из элементов, используя следующие данные:
2. Определите теплоту образования аммиака из элементов, используя следующие данные:
3. Определите теплоту образования карбоната магния из оксида магния и углекислого газа, пользуясь следующими данными:
4. Определить теплоту образования силиката кальция из оксидов кремния (4) и кальция, используя следующие данные:
5. Определите теплоту образования железа в реакции
6. Определить тепловой эффект реакции
7. Вычислить тепловой эффект реакции
8. При взаимодействии 10г металлического натрия с водой выделяется 79,910 кДж теплоты, а при взаимодействии 20г оксида натрия с водой выделяется 76,755 кДж теплоты, 9. Теплоты образования жидкой воды и оксида углерода (4) из элементов соответственно равны 285,84 кДж/моль и 393,514 кДж/моль, теплота сгорания метана равна 91,128 кДж/моль. Найти тепловой эффект образования метана из элементов.
10. Тепловой эффект образования
5. Расчёт тепловых эффектов при постоянном давлении и объёме.
По известному значению теплового эффекта реакции при постоянном давлении (Р=const) можно рассчитать для идеальных газов тепловой эффект реакции при постоянном объёме (V=const). Зная, из параграфа 3, что Qp=DU+PDV находим Qp=DH, DH=DU+PDV, но PV2=n2RT и PV1=n1RT. Так как T=const и P=const, то PDV=Dn×R×T и Qp=DU+Dn×R×T. В термодинамическом обозначении формула выглядит следующим образом: DH=DU+Dn×R×T или DU=DH–Dn×R×T, а в термохимическом: Qp=Qv–Dn×R×T или Qv= Qp+Dn×R×T, где R – газовая постоянная равна 0,0083 кДж/моль×К, Т – температура в К, Dn – изменение числа молей газообразных веществ: ПРИМЕР 1. Определить тепловой эффект реакции
3) Подставляем значения в формулу, связывающую QP и QV и находим QV:
ЗАДАЧИ:
1. Определить тепловой эффект реакции
2. Найти тепловой эффект реакций при постоянном объёме и температуре 25 °С: а) б) в) г) 3. Определить тепловой эффект реакции
4. Определите тепловой эффект реакции
|

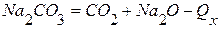 2) Записываем уравнения с заданными эффектами:
2) Записываем уравнения с заданными эффектами:
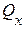 -?
-?
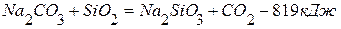
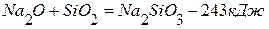
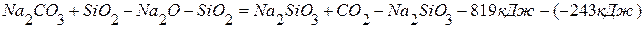
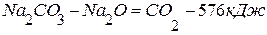 (перенесём
(перенесём 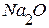 из левой части уравнения в правую с обратным знаком)
из левой части уравнения в правую с обратным знаком) 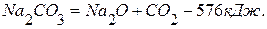
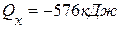 .
.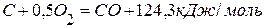 ,
, 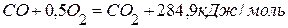 .
.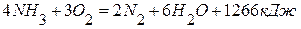 ,
, 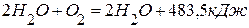 .
.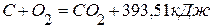 ,
,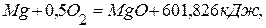
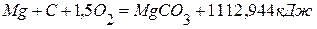 .
.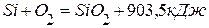 ,
,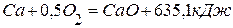 ,
, 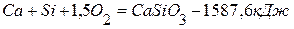 .
.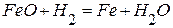 , используя следующие данные:
, используя следующие данные: 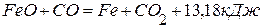 ,
,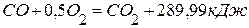 ,
, 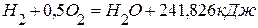
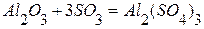 , используя следующие данные:
, используя следующие данные: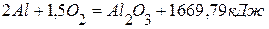 ,
, 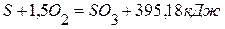 ,
,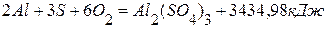 .
.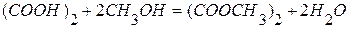 используя следующие данные:
используя следующие данные: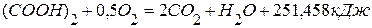 ,
, 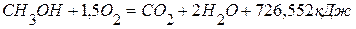 ,
,  .
.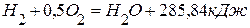 . Вычислить теплоту образования оксида натрия из элементов.
. Вычислить теплоту образования оксида натрия из элементов. из элементов равен 822,156 кДж/моль, а тепловой эффект образования
из элементов равен 822,156 кДж/моль, а тепловой эффект образования 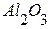 из элементов равен 1669,79 кДж/моль. Найти теплоту восстановления 1 моль
из элементов равен 1669,79 кДж/моль. Найти теплоту восстановления 1 моль 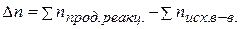 .
.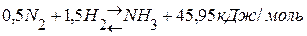 , если она протекает при постоянном объёме и температуре 298 К.
, если она протекает при постоянном объёме и температуре 298 К.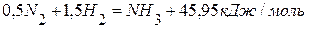 2) Находим изменение числа молей газообразных
веществ:
2) Находим изменение числа молей газообразных
веществ: 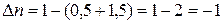
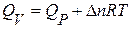 ;
; 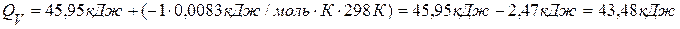 Ответ:
Ответ: 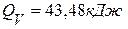 .
.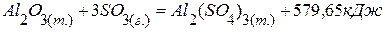 , если она протекает в автоклаве при постоянном объёме и температуре 298 К.
, если она протекает в автоклаве при постоянном объёме и температуре 298 К.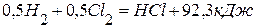 ;
;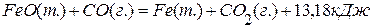 ;
;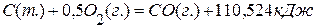 ;
;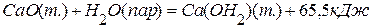 .
.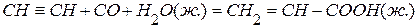 при постоянном давлении и температуре 25 °С, если тепловой эффект реакции при постоянном объёме равен
при постоянном давлении и температуре 25 °С, если тепловой эффект реакции при постоянном объёме равен  .
.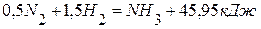 при постоянном объёме и температуре 673 К.
при постоянном объёме и температуре 673 К.


