Первый закон термодинамики. Первый закон термодинамики – это принцип сохранения и превращения энергии в применении к процессам, сопровождающимися выделением или поглощением теплоты
Первый закон термодинамики – это принцип сохранения и превращения энергии в применении к процессам, сопровождающимися выделением или поглощением теплоты, а так же совершением или затратой работы и изменением внутренней энергии системы. Предположим, что некоторая система за счёт поглощения из внешней среды теплоты переходит из состояния I в состояние II. В общем случае эта теплота расходуется на изменение внутренней энергии системы DU и на совершение работы против внешних сил А: Q=DU+А, где DU=Uкон.-Uнач., А=РDV=Р(Vкон.-Vнач.) Величина Q считается положительной, если теплота поглощается системой, и отрицательной, если теплота выделяется; работа А считается положительной, если система совершает работу, и отрицательной, если работа затрачивается на систему; DU считается положительной, если внутренняя энергия системы возрастает, и отрицательной, если она убывает.
ПРИМЕР 1. Найти изменение внутренней энергии при испарении 10 г воды при 20 °С и давлении 1×105 Па, приняв, что пары воды подчиняются законам идеальных газов и объём воды незначителен по сравнению с объёмом пара, теплота парообразования воды равна 40,700 кДж/моль.
4) Зная, что теплота парообразования – это количество теплоты, поглощённой при испарении 1 моль вещества, определяем количество теплоты, поглощённой системой при испарении 0,56 моль воды: При испарении 1 моль воды – поглощается 40,7 кДж теплоты; При испарении 0,56 моль воды – поглощается Q теплоты. Составляем пропорцию и находим Q:
5) Определяем объём пара, образующийся при испарении 0,56 моль воды, используя уравнение Клайперона-Менделеева:
6) Находим работу расширения пара:
7) Определяем изменение внутренней энергии: DU=22,79 кДж-1,36 кДж=21,43 кДж Ответ: DU=21,43 кДж. ЗАДАЧИ: 1. Найти изменение внутренней энергии при испарении 250 г бензола при температуре 25 °С и давлении 1×105 Па, приняв, что пары бензола подчиняются законам идеальных газов и объём бензола незначителен по сравнению с объёмом пара. Теплота парообразования бензола равна 30,800 кДж/моль. 2. Найти изменение внутренней энергии при испарении 30 г воды при температуре 50 °С и давления 1×105 Па, приняв, что пары воды подчиняются законам идеальных газов и объём воды незначителен по сравнению с объёмом пара. Теплота парообразования воды равна 40,700 кДж/моль. 3. Найти изменение внутренней энергии при испарении 100 г бензола при температуре 80 °С и давления 1×105 Па, приняв, что пары бензола подчиняются законам идеальных газов и объём бензола незначителен по сравнению с объёмом пара. Теплота парообразования воды равна 30,800 кДж/моль.
3. Расчёт тепловых эффектов реакций по теплотам образования реагентов Химические реакции можно проводить или при постоянном объёме (V=const) – изохорный процесс, или при постоянном давлении (P=const) – изобарный процесс. При изохорном процессе, поскольку изменение объёма системы не происходит, то A=0, тогда первый закон термодинамики примет вид: Q=DU+A, A=PDV; DV=0, поэтому A=0 Qv=DU Следовательно, если химическая реакция протекает при постоянном объёме, то выделение или поглощение теплоты Qv (тепловой эффект реакции) связано с изменением внутренней энергии системы.
Для химического процесса, протекающего изобарически, изменение объёма представляет собой разность между суммой объёмов продуктов реакции и суммой объёмов исходных веществ, тогда тепловой эффект реакции (Qp) равен: Qp=DU+ PDV, Qp=(U2- U1)+P(V2-V1) или DU= U2- U1, DV= V2-V1, p=(U2+ PV2)-(U1+PV1), введём обозначение U+PV=H, тогда Qp=H2-H1, Qp=DH Величину Н называют ЭНТАЛЬПИЕЙ (теплосодержанием). Таким образом, если при постоянном объёме тепловой эффект реакции равен внутренней энергии системы, то в случае постоянного давления тепловой эффект реакции равен изменению энтальпии системы. Поскольку подавляющее большинство химических реакций проходит при постоянном давлении, то в дальнейшем основное внимание будем уделять изобарным процессам. Непосредственное измерение энтальпии затруднено, поэтому применительно к каждой реакции говорят об изменении энтальпии DН. Стандартная энтальпия реакции обозначается как Знаки тепловых эффектов и изменений энтальпий для одной и той же реакции противоположны, т.е. для экзотермической реакции Q>0, DН0<0, для эндотермической реакции Q<0, DН0>0. Рассмотрим процесс образования жидкой воды из газообразных водорода и кислорода. При использовании термохимического правила знаков уравнения следует записывать следующим образом: 2Н2(г.)+О2(г.)=2Н2О(ж.)+571,6 кДж. При использовании термодинамического правила знаков уравнение следует записывать следующим образом: 2Н2(г.)+О2(г.)=2Н2О(ж.);
Стандартные энтальпии образования различных соединений – это табличные данные. Энтальпии образования простых веществ в наиболее устойчивой при данных условиях модификации равны нулю
Расчёт тепловых эффектов реакций ( ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ ЗАВИСИТ ТОЛЬКО ОТ СОСТОЯНИЯ ИСХОДНЫХ ВЕЩЕСТВ И ПРОДУКТОВ РЕАКЦИИ И НЕ ЗАВИСИТ ОТ ПУТИ ПРЕВРАЩЕНИЯ ВЕЩЕСТВ, Т.Е. ОТ НАЛИЧИЯ И ВИДА ПРОМЕЖУТОЧНЫХ РЕАКЦИЙ, ЧЕРЕЗ КОТОРЫЕ МОЖЕТ ПРОТЕКАТЬ ИТОГОВАЯ РЕАКЦИЯ. Проиллюстрируем закон на примере растворения безводной соли CuSO4 и её кристаллогидрата.
Таким образом, тепловой эффект реакции, протекающий в одну стадию равен сумме тепловых эффектов реакций, протекающих в две стадии. Но нас в большей степени будут интересовать следствия из закона Гесса: 1 следствие. Тепловой эффект химической реакции равен разноси сумм тепловых эффектов образования продуктов реакции и исходных веществ с учётом стехиометрических коэффициентов.
2 следствие. Тепловой эффект разложения какого-либо соединения равен и противоположен по знаку тепловому эффекту его образования.
3 следствие. Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным состояниям, то разность между тепловыми эффектами реакций представляет собой тепловой эффект перехода из одного конечного состояния в другое. 4 следствие. Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным состояниям, то разность между их тепловыми эффектами представляет собой тепловой эффект перехода из одного начального состояния в другое. 5 следствие. Тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учётом стехиометрических коэффициентов:
ПРИМЕР 1. Найти изменение энтальпии реакции ( СО(г.)+Н2О(ж.)=СО2(г.)+ Н2(г.), если известны теплоты образования соединений:
Ответ: ПРИМЕР 2. Найти тепловой эффект реакции СО(г.)+0,5О2(г.)=СО2(г.), если известны тепловые эффекты следующих реакций: С(графит)+О2(г.)=СО2(г.), С(графит)+0,5О2(г.)=СО(г.),
нение СО(г.)+0,5О2(г.)=СО2(г.) можно получить, если из первого уравнения вычесть второе: С(графит)+О2(г.)-С(графит)-0,5О2(г.)=СО2(г.)-СО(г.), получаем СО(г.)+0,5О2(г.)=СО2(г.), Ответ: ПРИМЕР 3. Найти тепловой эффект реакции С(графит)=С(алмаз), если известны тепловые эффекты следующих реакций: С(графит)+О2(г.)=СО2(г.),
Ответ:
ПРИМЕР 4. Найти тепловой эффект реакции
Ответ: Для нахождения тепловых эффектов реакций можно использовать значения энергии связи, тогда
ПРИМЕР 5. Определить тепловой эффект реакции, протекающей в газовой фазе по энергиям связей:
СН3 СН3 ОН
Ответ:
ЗАДАЧИ: 1. Найти изменение энтальпии реакции
2. Вычислить изменение энтальпии реакции 3. Найти энтальпию образования 4. Определить энтальпию образования этилена, если изменение энтальпии реакции 5. Определить тепловой эффект реакции
6. Определить тепловой эффект следующих реакций:
7. Определить тепловой эффект реакции
8. Определить тепловой эффект реакции
9. определить тепловой эффект реакции задачи №8, если известны тепловые эффекты сгорания веществ: 10. Определить тепловой эффект сгорания метилацетата по энергии разрыва связей:
11. Определить теплоту образования
4. Расчёт тепловых эффектов реакций при помощи системы термохимических
|

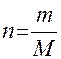 ;
; 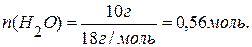
 , откуда
, откуда 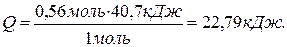

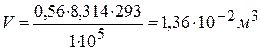
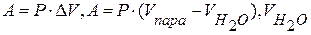 - можно пренебречь, тогда
- можно пренебречь, тогда

 .
.
 ) по теплотам образования как и многие другие термодинамические расчёты, осуществляются на основе осново-полагающего закона термодинамики, вытекающего из закона сохранения энергии – закона ГЕССА.
) по теплотам образования как и многие другие термодинамические расчёты, осуществляются на основе осново-полагающего закона термодинамики, вытекающего из закона сохранения энергии – закона ГЕССА.
 ;
; 

 .
. ;
; 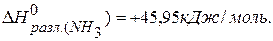
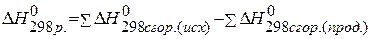
 )
)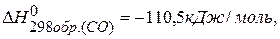
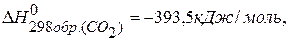
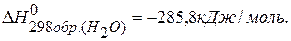
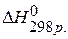 :
:



 -?
-?
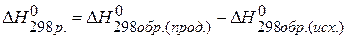


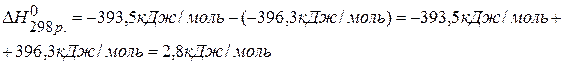




 2) Используя 3 следствие из закона Гесса
2) Используя 3 следствие из закона Гесса
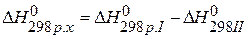
 , значит урав-
, значит урав-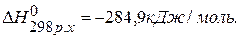
 , С(алмаз)+О2(г.)=СО2(г.),
, С(алмаз)+О2(г.)=СО2(г.),  .
.


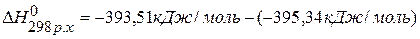

 , значит С(графит)=С(алмаз),
, значит С(графит)=С(алмаз),  .
.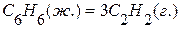 , если известны теплоты сгорания соединений:
, если известны теплоты сгорания соединений: 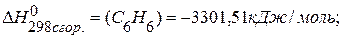

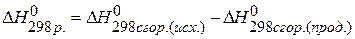
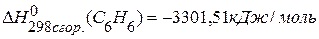
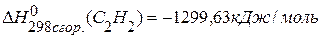
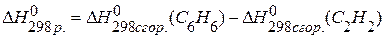

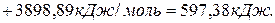


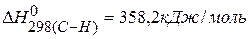 ,
,  ,
,  ,
,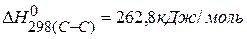 ,
,  ,
,  .
.


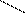 СН3 СН3
СН3 СН3


 С=О + СНºСН= С – СºСН, СН3 СН3 ОН
С=О + СНºСН= С – СºСН, СН3 СН3 ОН
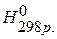 2) Используя выше описанное правило находим
2) Используя выше описанное правило находим 
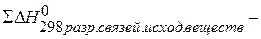

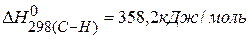
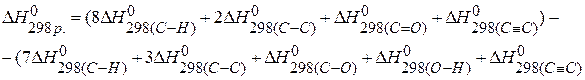
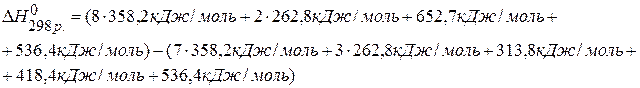

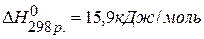
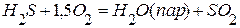 , если
, если 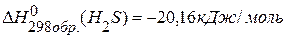 ,
, 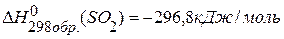 ,
,  .
.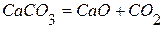 , если
, если 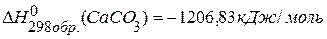 ,
, 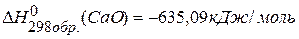 ,
, 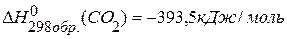 .
.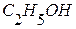 , если изменение энтальпии реакции
, если изменение энтальпии реакции  равно –1366,745 кДж,
равно –1366,745 кДж, 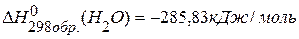 ,
, 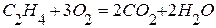 равно –1323кДж,
равно –1323кДж, 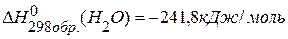 .
. , если известны эффекты следующих реакций:
, если известны эффекты следующих реакций: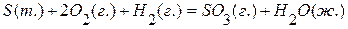 ,
,  ,
, 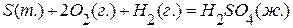 ,
,  .
.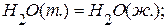

 , если известны тепловые эффекты следующих реакций:
, если известны тепловые эффекты следующих реакций: ,
,  ,
,  ,
, 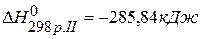 ,
,  ,
,  .
. , если известны теплоты сгорания:
, если известны теплоты сгорания: 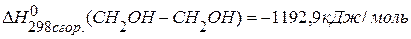 ,
, 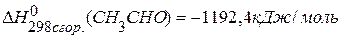 ,
, 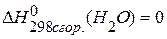 .
. , если известны тепловые эффекты образования веществ:
, если известны тепловые эффекты образования веществ:  ,
, 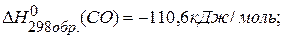
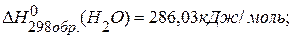
 .
. ,
,  ,
, 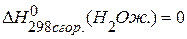 ,
, 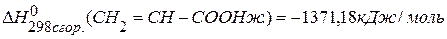 .
. ,если
,если 
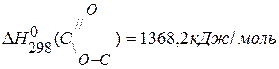 ,
, 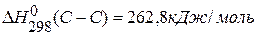 ,
, 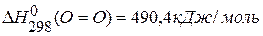 ,
, 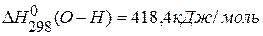 ,
,  .
. , если изменение энтальпии реакции
, если изменение энтальпии реакции 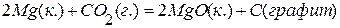 равно –810,1 кДж,
равно –810,1 кДж,  .
.


