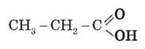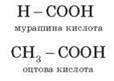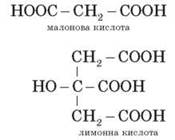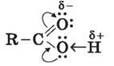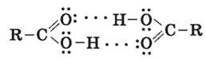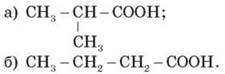Тема урока. Карбоновые кислоты. Насыщенные карбоновые кислоты. Физические свойства. Номенклатура.
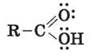
Цели урока: развивать знания учащихся о карбонильные органические соединения на примере карбоновых кислот; формировать знания о карбоксильную функциональную группу на примере карбоновых кислот; ознакомить учеников со структурной и электронной формулами уксусной кислоты; показать связь между функциональной карбоксильной группой и физическими и химическими свойствами карбоновых кислот; формировать представление о гомологический ряд одноосновных карбоновых кислот, изомерию и структурные формулы. Тип урока: изучение нового материала. Формы работы: учебная лекция, эвристическая беседа, лабораторный эксперимент. Лабораторный опыт 5. Действие уксусной кислоты на индикаторы. Ход урока I. Организация класса II. Проверка домашнего задания. Мотивация учебной деятельности 1. У доски ученики пишут уравнения реакций схемы преобразований: CH4 2. Запишите формулы двух изомеров и двух ближайших гомологов вещества 2-метил-1-пропанол. 3. Эвристическая беседа 1) Что такое функциональная группа? Какие функциональные группы вы знаете? 2) физические и химические свойства спиртов обусловлены наличием функциональной гидроксильной группы? 3) Какие физические и химические свойства альдегидов обусловлены наличием функциональной гидроксильной группы? 4) Запишите формулу уксусной кислоты. (С помощью учителя ученики записывают формулу на доске, учитель корректирует.) В этой формуле присутствует гидроксигруппа и карбонильная группа. можно утверждать, что физические и химические свойства уксусной кислоты будут такими же, как в этилового спирта и этаналя? Рассмотрим на опыте. 4. Лабораторный опыт 5. Действие уксусной кислоты на индикаторы Мы знаем, что спирты не действуют на индикаторы. Проведем эксперимент. В три пробирки нальем по 1 мл раствора уксусной кислоты. В первую добавим несколько капель лакмуса, во вторую - метилового оранжевого, в третью - фенолфталеина. как изменилась окраска индикатора? Для сравнения параллельно возьмем три пробирки с соляной кислотой и проведем тот же эксперимент. Сравните наблюдения и сделайте вывод. Вывод: уксусная кислота действует на индикаторы так же, как и неорганические кислоты. III. Изучение нового материала 1. Насыщенные одноосновные карбоновые кислоты Органические вещества, молекулы которых содержат одну или несколько функциональных карбоксильных групп, соединенных с углеводородами, называются карбоновыми кислотами. Общая формула карбоновых кислот: R - (COOH) n. Карбоновые кислоты - органические соединения, содержащие одну или несколько карбоксильных групп -COOH, соединенных с углеводородным радикалом. Карбоксильная группа содержит две функциональные группы - карбонил
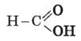
Простейшие карбоновые кислоты
2. Классификация карбоновых кислот Карбоновые кислоты классифицируют по двум структурным признакам. 1) по числу карбоксильных групп кислоты делятся на: • одноосновные (монокарбоновые). Например:
• многоосновные (дикарбоновые, трикарбоновые т.д.):
2) По характеру углеводородного радикала различают кислоты: • насыщенные (CH3CH2CH2COOH); • ненасыщенные (CH2 = CHCH2COOH); • ароматические (RC6H4COOH). 3. Номенклатура карбоновых кислот Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова «кислота». Часто используются также тривиальные названия. Некоторые насыщенные одноосновные кислоты
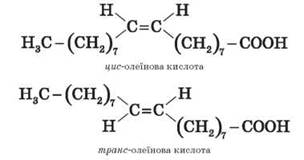
4. Изомерия карбоновых кислот структурная изомерия • Изомерия скелета в углеводородном радикале (начиная с C4); • межклассовая изомерия, начиная с C2. Например, формуле C2H4O2 соответствуют три изомера, относящихся к различным классам органических соединений. пространственная изомерия Возможна цис-транс-изомерия в случае ненасыщенных карбоновых кислот. Например:
5. Строение карбоксильной группы Карбоксильная группа сочетает в себе две функциональные группы - карбонильную и гидроксильную взаимно влияют друг на друга:
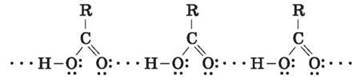
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи O - H. В водном растворе карбоновые кислоты диссоциируют на ионы: R - COOH → RCOO- + H+ Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
Образование димеров карбоновых кислот
Ассоциация молекул карбоновых кислот С увеличением молекулярной массы растворимость кислот в воде уменьшается. IV. Первичное применение полученных знаний 1. Запишите уравнения диссоциации уксусной кислоты. CH3 - COOH 2. Почему карбоновые кислоты проявляют свойства, подобные свойствам неорганических кислот? 3. Дайте названия по систематической номенклатуре нижеследующим соединениям:
Можно считать эти соединения гомологами? изомерами? Составьте ближайшие гомологи и изомеры вещества б), назовите их по систематической номенклатуре. 4. Почему среди карбоновых кислота не газообразных веществ? 5. Сколько изомерных одноосновных карбоновых кислот может соответствовать формуле C6H12O2? Напишите структурные формулы этих кислот и назовите их. V. Подведение итогов урока Оценка работы учащихся на уроке. VI. Домашнее задание Проработать материал параграфа, ответить на вопросы к нему, выполнить упражнения. Творческое задание: подготовить схему (таблицу, презентацию) применение карбоновых кислот. Урок 16 (26.02.15)
|

 CH3Cl
CH3Cl 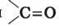 і гидроксил -OH, которые непосредственно связаны между собой:
і гидроксил -OH, которые непосредственно связаны между собой: