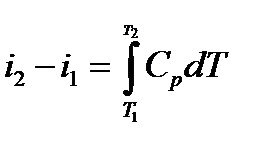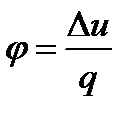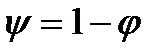Основные термодинамические свойства идеальных газов
При исследовании термодинамических процессов используется уравнение состояния
и математическое выражение первого закона термодинамики
или
При изучении термодинамических процессов идеальных газов, в общем случае требуется определить уравнение кривой процесса в PV, PT, VT диаграмме, установить связь между термодинамическими параметрами и определить следующие величины: − изменение внутренней энергии рабочего тела
(формула справедлива не только для V=const, но и для любого процесса) − определить внешнюю (термодинамическую) удельную работу
и располагаемую удельную работу
−количество теплоты, участвующей в термодинамическом процессе
Где –изменение энтальпии в термодинамическом процессе
(формула справедлива не только при p=const, но и в любом процессе)
– доля теплоты, которая расходуется на изменение внутренней энергии в данном процессе:
–доля теплоты, превращается в полезную работу в данном процессе
В общем случае любые два термодинамических параметра из трех (P,V,T) могут изменяться произвольно. Для практики наибольший интерес представляют следующие процессы: 1) Процессы при постоянном объеме (V=const) – изохорный. 2) При постоянном давлении (P=const) – изобарный. 3) При постоянной температуре (T=const) – изотермический. 4) Процесс dq=0 (протекающий без теплообмена рабочего тела с окружающей средой) – адиабатный процесс. 5) Политропный процесс, который, при определенных условиях, можно рассматривать как обобщающий по отношению ко всем основным процессам. В дальнейшем будем рассматривать 1-й закон термодинамики и величины, входящие в него, как отнесенные к 1кг массы.
|


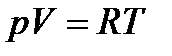
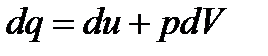
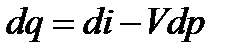
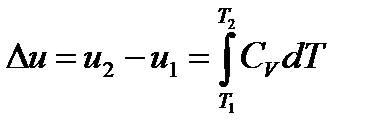
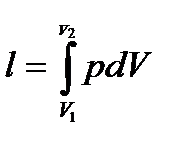
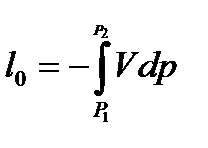
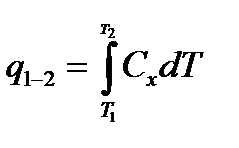
 – теплоемкость процесса
– теплоемкость процесса