Рассчитать титр 0,2н раствора серной кислоты по карбонату кальция.
1) 0,0098 г/мл; 2) 0,01 г/мл; 3) 0,02 г/мл; 4) 0,098 г/мл.
18. Определить рОН, если [H+] = 10-6. 1) 6; 2) 8; 3)10-8; 4) 10-4.
19. Что такое ХПК при анализе сточных вод? 1) химическое поглощение кислорода; 2) химический показатель кислорода; 3) химический показатель кислотности; 4) химическое помутнение кислоты
20. Определить содержание влаги в мочевине (%), если масса бюкса с пробой до сушки составила 27,40 грамма, после сушки – 27,25 грамма, а масса взятой пробы 5,0грамм. 1) 5%; 2)3%; 3)30%; 4) 0,30%
21. Определить объёмный титр 0,2н раствора серной кислоты по аммиаку. 1) 2,22 л/мл; 2)3,4 г/мл; 3)2,22 г/мл; 4) 3,4 л/мл.
22. Определить питательную ценность аммиачной селитры (%). а) 46,0%; 2) 24,3%; 3) 35%; 4) 17,5%.
В1. Определить концентрацию серной кислоты (%), если на титрование 1,95г навески серной кислоты израсходовано 5,6 мл 1н раствора серной кислоты. Объём раствора 1н гидроксида натрия, залитого в пробу, составляет 10 мл.
Ответ: 11,06 %; В2. Определить объёмную долю диоксида серы в газах обжига (%), если 500мл пробы газа (t = 200C, р = 767 мм ртутного.столба) обесцветили 22,5 мл 0,2н раствора йода (kJ2 = 1,01). Ответ: 10%
С1. Сформулировать сущность метода определения концентрации серной кислоты, написать уравнения реакций, которые имеют место в этом методе определения. Ответ:
С2. Составить алгоритм определения концентрации серной кислоты, записать расчётную формулу, используемую в данном методе, и проанализировать ее. Ответ: Эталон ответов для проверки результатов педагогического теста Части С Вариант 1 С1. Содержание диоксида углерода определяется методом нейтрализации, обратным титрованием. Растворённый в воде диоксид углерода под действием, добавленного к пробе, гидроксида натрия, переходит в карбонат натрия. Избыток гидроксида натрия и карбонат натрия оттитровывают серной кислотой в присутствии индикатора фенолфталеина. При этом в присутствии фенолфталеина карбонат натрия оттитровывается только наполовину – до бикарбоната натрия. Разность между объёмами щёлочи, взятой для связывания диоксида углерода, и кислоты, пошедшей на титрование избытка щёлочи и половины карбоната натрия, эквивалентна содержанию углекислого газа. Уравнения реакций: CO2 + 2NaOH = Na2CO3 + H2O 2NaOH + H2SO4 = Na2SO4 + 2H2O 2Na2CO3 + H2SO4 = 2NaHCO3 + Na2SO4
С2 Алгоритм определения содержания диоксида углерода: 1. Мерной колбой на 50мл отбираем пробу исследуемой воды. 2. Помещаем отобранную пробу в коническую колбу на 250мл. 3. Добавляем в пробу из бюретки 10 мл 0,1н раствора гидроксида натрия. 4. Добавляем в титруемый раствор 2-3 капли индикатора метилового оранжевого. 5. Оттитровываем полученный раствор 0,1н раствором серной кислоты до перехода окраски раствора из жёлтой в оранжевую. Формула для определения содержания диоксида углерода в воде имеет вид:
где V(NaOH) – объём 0,1 н раствора гидроксида натрия, прилитого к пробе, мл k((NaOH) – поправочный коэффициент к концентрации раствора гидроксида натрия V(H2SO4) – объём 0,1 н раствора серной кислоты, пошедшего на титрование, мл k(H2SO4) – поправочный коэффициент к концентрации раствора серной кислоты Сэкв (H2SO4, NaOH) – молярная концентрация эквивалента растворов гидроксида натрия и серной кислоты, моль/л 2 – коэффициент, учитывающий, что в присутствии фенолфталеина оттитровывается только половина карбонат – ионов Мэкв(СО2) – молярная масса эквивалента диоксида углерода, г/ моль 1000 – коэффициент перевода грамм в миллиграммы V(H2O) – объём воды, взятой для анализа, мл
Вариант 2 С1. Содержание сероводорода в воде определяется методом йодометрии, обратным титрованием Сероводород окисляется йодом в кислой среде. Избыток йода оттитровывается раствором тиосульфата натрия в присутствии крахмала. Крахмал добавляют в конце титрования для того, чтобы была более заметна точка эквивалентности. . Уравнения реакций: H2S + I2 = 2HI + S I2 + 2Na2S2O3 = 2NaI + Na2S4O6
С2. Алгоритм определения содержания сероводорода в воде: 1. Мерной колбой на 50мл отбираем пробу исследуемой воды. 2. Помещаем отобранную пробу в коническую колбу на 250мл. 3. Добавляем в пробу из бюретки 10 мл 0,1н раствора йода. 4. Добавляем в колбу 3-4 мл 5%-ного раствора уксусной кислоты. 5. Оттитровываем полученный раствор 0,1н раствором тиосульфата натрия до бледно-жёлтого окрашивания раствора. 6. Добавляем в титруемый раствор 3-4 капли индикатора крахмала. Формула для определение содержания сероводорода в воде имеет вид
где V(J2) – объём 0,1 н раствора йода, прилитого к пробе, мл k(J2) – поправочный коэффициент к концентрации раствора йода V(Na2S2O3) – объём 0,1 н раствора тиосульфата натрия, пошедшего на титрование, мл k(Na2S2O3) – поправочный коэффициент к концентрации раствора серной кислоты Сэкв (J2, Na2S2O3) – молярная концентрация эквивалента растворов йода и тиосульфата натрия, моль/л Мэкв(H2S) – молярная масса эквивалента сероводорода, г/ моль 1000 – коэффициент перевода грамм в миллиграммы V(H2O) – объём воды, взятой для анализа, мл
Вариант 3 С1. Концентрация серной кислоты определяется методом нейтрализации, обратным титрованием. Метод основан на нейтрализации кислоты избытком щёлочи. Избыток щёлочи оттитровывается раствором серной кислоты. 2. Уравнение реакции: H2SO4 + 2NaOH = Na2SO4 +2Н2O
С2.. Алгоритм определения концентрации серной кислоты 1. На аналитических весах взвешиваем стаканчик с точностью до 0,0001г. 2. В стаканчик отбираем пипеткой 1 мл исследуемой кислоты. 3. Взвешиваем стаканчик с исследуемой кислотой на аналитических весах с точностью до 0,0001г. 4. В коническую колбу на 100мл отбираем пипеткой 10 мл 1н гидроксида натрия. 5. Количественно переносим навеску исследуемой кислоты в коническую колбу к 1н раствору гидроксида натрия. 6. Добавляем 2-3 капли индикатора метилового красного. 7. Титруем полученный раствор 1н раствором серной кислоты до перехода окраски раствора из жёлтой в оранжевую. Формула для определения концентрации серной кислоты
где VNaOH - объём 1н раствора гидроксида натрия, мл kNaOH - поправочный коэффициент 1н раствора гидроксида натрия VH2SO4 - объём 1н раствора серной кислоты, затраченный на титрование избытка гидроксида натрия, мл k H2SO4 - поправочный коэффициент 1н раствора серной кислоты; Tnaoh/h2S04~ титр 1н раствора гидроксида натрия по серной кислоте, г/мл m(навески)– масса 1 мл серной кислоты, г 100 – перевод в проценты
|

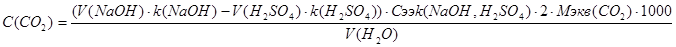 .
. ,
,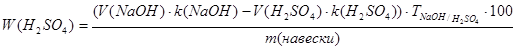 ,
,


