Строение атома
СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
Химия – наука о веществах, их превращениях и явлениях, сопровождающих эти превращения. В результате химических процессов образуются новые вещества с новыми химическими и физическими свойствами. Вещество представляет собой отдельный вид материи, дискретные частицы которого имеют конечную массу покоя. Веществом являются такие элементарные частицы, как протон, нейтрон, электрон и др. Сочетанием этих элементарных частиц образуются ядра атомов, атомы, молекулы, ионы, кристаллы и т.п. Объектом изучения в химии являются химические элементы и их соединения. Химическим элементом называют вид атомов с одинаковым зарядом ядер. Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства. Таким образом, каждому химическому элементу соответствует определенный вид атомов. Наименьшую частицу индивидуального вещества, способную к самостоятельному существованию, обладающую его основными химическими свойствами, называют молекулой. Свойства вещества как вида материи, состоящего из дискретных частиц, имеющих массу покоя, определяются типом и количеством объединившихся частиц и описываются периодическим законом Д.И. Менделеева: свойства химических элементов и образуемых ими простых и сложных веществ являются периодической функцией положительно заряженного ядра атомов элементов. Строение атома
Атом представляет собой сложную микросистему находящихся в движении и взаимодействии элементарных частиц. Экспериментально установлено, что атом состоит из двух областей, несущих противоположные заряды. Заряд области, где сосредоточена почти вся масса атома, условно принято считать положительным. Эта область названа ядром атома. Область положительного заряда атома – ядро - несмотря на преобладание ее массы очень невелика по размерам. За исключением ядра атома водорода, ядра атомов состоят из протонов и нейтронов, называемых нуклонами. Протон р– частица имеющая массу mp = 1,6726 ·10-27кг и положительный электрический заряд 1,6022·10-19 Кл. Нейтрон n – незаряженная частица, обладающая массой mn = 1,6750 ·10-27кг. На некотором расстоянии от ядра располагаются области с противоположным зарядом – так называемые электронные орбитали – области определенной вероятности нахождения электрона. Электрон – элементарная частица, обладающая наименьшей массой покоя m Общее число электронов в атоме равно числу протонов в ядре и поэтому атом электрически нейтрален. Геометрический размер атома, условно описываемый диаметром его электронной оболочки, имеет порядок 10-10 м, а диаметр атомного ядра – 10-14 м, т.е. по размеру ядро в 10 000 раз меньше, чем атом. Масса атома чрезвычайно мала и сосредоточена в его ядре. Обычноее выражают в атомных единицах массы (а. е. м.). В качестве атомной единицы массы принята Число протонов Z в ядре равно заряду ядра, если выражать заряд в единицах заряда электрона. Сумма числа протонов Z и числа нейтронов N равна массовому числу А, т.е. массе атома, выраженной в единицах атомных масс и округленных до целых единиц. Существуют ядра с одним и тем же значением Z, но различным значением А, т.е. ядра с различным содержанием нейтронов N. Атомы, имеющие одинаковый заряд ядра, но разное количество нейтронов, называют изотопами. Так, ядра изотопов урана содержат по 92 протона, но различаются по числу нейтронов: Атомы всех изотопов одного и того же элемента имеют одинаковое электронное строение, а сами изотопы – близкие химические свойства. Таким образом, главной характеристикой атома является величина положительного заряда ядра атома, определяющая общее число электронов в атоме и химические свойства элемента. Так как в возникновении химических связей и в образовании молекул веществ происходят изменения электронной конфигурации атомов, то именно изучению этой структуры уделяют особое внимание.
|

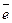 = 0,91095·10-30 кг. Заряд электрона принято считать отрицательным. Электроны имеют отрицательный электрический заряд, равный 1,6022·10-19 Кл.
= 0,91095·10-30 кг. Заряд электрона принято считать отрицательным. Электроны имеют отрицательный электрический заряд, равный 1,6022·10-19 Кл.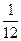 массы атома изотопа углерода
массы атома изотопа углерода 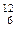 С.
С.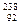 U (А = 238, Z = 92, N = 146);
U (А = 238, Z = 92, N = 146); 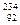 U (А = 234, Z = 92, N = 142);
U (А = 234, Z = 92, N = 142); 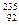 U (А = 235, Z = 92, N = 143),
U (А = 235, Z = 92, N = 143), 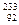 U (А =233, Z = 92, N =141).
U (А =233, Z = 92, N =141).


