Строение многоэлектронных атомов
Электронные конфигурации элемента. Запись распределения электронов в атоме по уровням, подуровням и орбиталям называется электронной конфигурацией элемента. Обычно электронная конфигурация приводится для основного состояния атома. При записи электронной конфигурации указывают цифрами главное квантовое число (n), буквами – орбитальное квантовое число (l). Количество электронов на подуровне обозначают числом в виде степени буквенного обозначения подуровня. Например, электронная конфигурация водорода Н – 1 s 1, магния Mg - 1 s 22 s 2 2 p6 3 s 2, титана Ti - 1 s 2 2 s2 2 6 3 s 2 3 p 6 3 d2 4 s 2. При составлении электронных конфигураций многоэлектронных атомов учитывают: принцип наименьшей энергии, принцип Паули, правила Гунда и Клечковского. Принцип наименьшей энергии. Современная теория строения атома позволила объяснить электронную структуру всех элементов и показала, что конфигурация электронной структуры невозбужденного атома однозначно определяется зарядом ядра. При заполнении электронами уровней и подуровней последовательность размещения электронов в атоме должна отвечать как наименьшей энергии электрона, так и наименьшей энергии атома в целом. Наиболее устойчивым состоянием атома является такое, в котором электроны находятся на наиболее близких ядру энергетических уровнях. При переходе от одного элемента к другому электроны будут постепенно заполнять подуровни и уровни в порядке возрастания их энергии. Однако вследствие взаимодействия электронов между собой в многоэлектронных атомах порядок заполнения уровней и подуровней отличается от ожидаемого в соответствии с расположением энергетических уровней в атоме водорода. Правило суммы (n + l) позволяет предвидеть отличия в расположении энергетических уровней у многоэлектронных атомов от атома водорода. Правило Клечковского. Увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел (n + l), а при равной сумме (n + l) - в порядке возрастания числа n. Соответственно этому правилу последовательность заполнения электронами уровней и подуровней имеет следующий вид:
1 s <2 s < 2р <3 s <3 р < 4s<3d < 4р<5s <4 d <5 p <6 s <4 f ≈ 5 d <6 p <7 s <5 f ≈ 6 d <7 p.
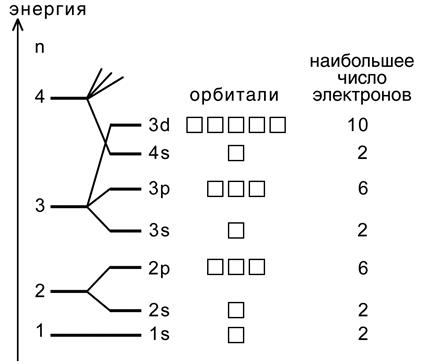
Последовательность возрастания энергии определена опытным путем и называется шкалой энергии. Исключение составляют d - и f –элементы с полностью и наполовину заполненными подуровнями (случаи повышенной устойчивости подуровней), у которых наблюдается так называемый «проскок» электронов, например Cr, Cu, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Pt. В выделенном фрагменте 4s <3 d энергия подуровня 4 s меньше, чем 3 d, так как для 4 s –подуровня сумма (n+ l) = 4 + 0 = 4, а для 3 d –подуровня - (n + l) = 3 + 2 = 5, поэтому вначале происходит заполнение 4 s –подуровня, затем - 3 d. Энергия 4р <5s, так как сумма (n + l) равна 5 в обоих случаях (4р → 4+1 = 5; 5s → 5 + 0 = 5). Поэтому сначала заполняется подуровень с меньшим значением главного квантового числа, т.е. 4р. На рис. 3 приведена последовательность заполнения электронных орбиталей для первых энергетических уровней.
Рис.3. Порядок заполнения орбиталей первых энергетических уровней
Порядок заполнения орбиталей данного энергетического подуровня подчиняется правилу Гунда, согласно которому минимальной энергии атома соответствует такое распределение электронов по атомным орбиталям данного подуровня, при котором абсолютное значение суммарного спина атома максимально. Иными словами, при заполнении электронами атомных орбиталей данного подуровня сначала на каждой атомной орбитали размещается по одному электрону и только после заполнения всех АО в каждой из них может расположиться 2-й электрон. Электроны с противоположными спинами на одной и той же АО образуют двухэлектронное облако, и их суммарный спин равен нулю. Например, если в атоме азота (N) имеется семь электронов (электронная формула азота 1s22s22p3), то они будут распределяться согласно правилу Гунда по АО одним единственным способом:
|