Квантово - механическое объяснение строения атома
Химические свойства элементов определяются строением электронных оболочек атома, так как при химических реакциях ядра атомов не претерпевают изменений. Современная теория строения атома основана на законах, описывающих поведение микрообъектов – микрочастиц, элементарных частиц и электронов в том числе. Представление о поведении электронов как микрочастиц основано на следующих трех положениях: 1) квантовый характер энергетических изменений; 2) двойственное корпускулярно-волновое поведение; 3) неопределенность положения и скорости при одновременном их измерении. Квантовый характер энергетических изменений. В системе микрообъектов энергия поглощается и испускается не непрерывно, а дискретно, отдельными порциями – квантами. Энергия электрона в атоме не может быть произвольной, она принимает только пределенные значения, кратные числам квантов. Энергия кванта Е пропорциональна частоте излучения (колебания)
Е = h
где h - постоянная Планка (6,626 · 10-34 Дж · с); Из этих соотношений, в частности, следует, что чем меньше длина волны или чем больше частота колебаний, тем больше энергия кванта, и наоборот. Поэтому ультрафиолетовые лучи обладают большей энергией, чем лучи видимого света. Квантовый характер энергетических изменений особенно ярко проявляется в спектрах веществ и, в первую очередь, – в атомных спектрах. Атомные спектры состоят из отдельных спектральных линий. Каждая спектральная линия характеризуется определенной частотой колебаний света
h Атомные спектры возникают при переходах между энергетическими уровнями внешних электронов атомов. Каждому элементу отвечает свой спектр, т.е. каждому виду атомов присущ свой характеризующий его прерывистый (дискретный) ряд значений внутренней энергии. Отсюда следует невозможность для атома непрерывно изменять свое состояние и в связи с этим невозможность как поглощать, так и испускать энергию любыми, в том числе бесконечно малыми, порциями. Атом элемента, поглотив энергию, через некоторый очень короткий промежуток времени снова самопроизвольно возвращается в первоначальное состояние, излучая поглощенную энергию в количестве одного кванта (h Корпускулярно-волновое поведение. Электроны – микрочастицы, обладающие рядом свойств, которые присущи и волнам и частицам. Корпускулярные свойства (свойства частицы) электрона выражаются в его неспособности дробиться, в наличии массы и способности оказывать давление. Волновые свойства выражаются в особенностях движения, в дифракции и интерференции. Энергия кванта излучения связана с частотой излучения уравнением Планка (1). В то же время масса частицы m связана с ее энергией Е и скоростью с формулой Эйнштейна (Е = mс2). Двойственность свойств частицы (электрона) отражается соотношением (уравнением де Бройля) между скоростью частицы, ее массой и длиной:
Соотношение «волна-частица» таково, что с уменьшением массы частицы ее волновые свойства усиливаются, а корпускулярные ослабляются, а с увеличением частоты и уменьшением длины волны происходит усиление корпускулярных свойств. Неопределенность положения и скорости (принцип не о пределенности Гейзенберга). В микромире вообще принципиально нельзя определить точно положение и скорость частиц, т.е. микрочастицы вообще не имеют вполне точных положений и скоростей. Если невозможно одновременно установить местонахождение в пространстве и скорость движения электронов, то нельзя точно описать размеры и формы их орбиты, а также размер и форму атома. Все, что можно сказать о положении электрона в атоме, - это только вероятность его нахождения в какой-либо области пространства вблизи ядра. Наиболее распространенным является представление электрона в виде зарядного (электронного) облака, т.е. области пространства вокруг ядра атома, где находится преобладающая часть заряда и массы электрона. Исходя из квантового характера энергетических изменений, корпускулярно-волнового поведения микрочастиц, неопределенности положения и скорости микрочастицы, австрийский физик Шредингер и ряд других ученых разработали теорию движения микрочастиц – волновую механику, которая привела к созданию современной квантово - механической модели атома. Квантовая механика описывает движение электрона в атоме при помощи волновой функции. Общий вид этой функции находится из уравнения Шредингера, которое связывает волновую функцию с потенциальной энергией электрона и его полной энергией. Математический аппарат волновой механики в применении к модели атома очень сложен. Уравнение Шредингера точно решено для атома водорода и для одноэлектронных ионов He+, Li2+. Решая уравнения, находят значения волновых функций, характеризующих вероятность нахождения электрона в некотором пространстве вблизи ядра атома, а также определяют возможные энергетические состояния электрона. Решение уравнения Шредингера даже для атома водорода – очень сложная задача, так как это уравнение имеет бесконечно большое число решениий в связи с тем, что энергия электрона может принимать бесконечно большое число квантовых значений. Однако все решения можно разделить на три серии и ограничиться только теми значениями энергии, которые один электрон может принимать в поле ядра атома водорода (протона). Три серии решений уранения объединяются значениями связанных между собой квантовых чисел. Для характеристики энергетического состояния электрона в атоме квантовая механика пользуется системой квантовых чисел. Главное квантовое число n. Электроны, движущиеся вокруг атома, группируются в энергетические уровни (оболочки). Принадлежность электрона к тому или иному энергетическому уровню определяется главным квантовым числом n. Главное квантовое число принимает значения 1, 2, 3, 4, 5, …..∞. Значение главного квантового числа соответствует номеру периода в периодической системе; для всех известных элементов n изменяется от 1 до 7. Энергетические уровни имеют буквенные обозначения: K (n = 1), L (n = 2), M (n = 3), N (n = 4), O (n = 5), P (n = 6), Q (n = 7). Главное квантовое число определяет энергию электрона, находящегося на данном энергетическом уровне и размеры электронного облака. Побочное (орбитальное) квантовое числоI. Электроны каждого уровня группируются в подуровни, причем число возможных подуровней равно номеру уровня и определяется побочным или орбитальным квантовым числом (I). Побочное (орбитальное) квантовое число I может принимать значения от нуля до n – 1 (n ≤ 4). Необходимость введения побочного квантового числа подтверждается изучением спектра атома водорода. Спектральные линии, отвечающие переходам с одного уровня на другой, часто состоят из нескольких очень близко расположенных отдельных линий. Это указывает на незначительное различие в энергии электронов одного и того же энергетического уровня. Поэтому уровни, кроме первого, разделяют на подуровни, которые обозначают буквами s, p, d, f соответственно значениям I:
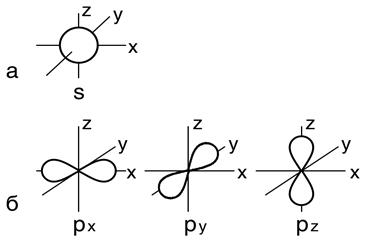
Первый энергетический уровень (n =1) содержит 1 подуровень - 1 s; второй (n =2) – два подуровня - 2 s, 2 p; третий (n =3) – три подуровня -3 s, 3 p, 3 d; четвертый (n =4) - 4 s, 4 p, 4 d, 4 f и т.д. Число подуровней в каждом данном уровне равно главному квантовому числу. Орбитальное квантовое число определяет форму поверхности максимальной вероятности нахождения электрона и ее симметрию. Электронное облако s –подуровня имеет вид сферической поверхности и не обладает направленностью в пространстве (рис. 1, 2,а). Облака р - подуровня имеют форму объемной восьмерки и расположены взаимно перпендикулярно (рис. 2,б). Форма d - орбиталей значительно сложнее формы р – облаков. Магнитное квантовое число ml х арактеризует пространственное расположение электронных облаков, т.е. ориентацию в пространстве. Число значений, принимаемых m l,зависит от значения побочного квантового числа l и указывает на число орбиталей с данным значением I и может принимать значения от - l, проходя через нуль, до + l: m l = - l….0…. + l.
Рис. 1. s – орбитали в зависимости от n
Рис. 2. Форма s (а) – и p (б) – электроных облаков
Число орбиталей с данным значением l равно (2 l + 1). При I = 0, m l принимает только одно значение, т.е. s -подуровень содержит одну атомную орбиталь. При I = 2 m l принимает три значения, на р - подуровне находятся 3 атомные орбитали, которые отличаются друг от друга своей ориентацией в пространстве по 3 осям координат и обозначаются как рХ, ру, рz - облака (рис. 2,б). На d - и f - подуровнях содержится соответственно 5 и 7- орбиталей. Физический смысл магнитного квантового числа заключается в том, что в спектрах атомов, помещенных во внешнее магнитное поле, обнаруживается дополнительное расщепление спектральных линий. Возникновение новых близлежащих линий свидетельствует о том, что в магнитном поле энергия электронов изменяется. Но это возможно только в случае различной взаимной ориентации электронных облаков. Это говорит о том, что s – электронное облако имеет шаровую симметрию (рис.2,а), р - подуровни расщепляются в магнитном поле на три различных типа ориентации р – облаков в пространстве (рис. 2,б). Состояние электрона в атоме, которое характеризуется одинаковыми значениями квантовых чисел n, l и ml, т. е. определенными размером, формой и ориентацией в пространстве электронного облака, называется атомной электронной орбиталью (АО) или квантовой ячейкой (иногда их называют ячейки Гунда). Схематически квантовые ячейки принято обозначать в виде клеточки □. Соответственно, s – подуровень состоит из одной АО □, p – подуровень – из трех АО □□□, d – подуровень – из пяти АО □□□□□, f – подуровень – из 7 АО □□□□□□□. Каждый энергетический уровень включает n 2 - орбиталей и на нем может располагаться 2 n 2 электронов. Максимальное число электронов на подуровне равно 2(2 l +1), табл. 1. Для полной характеристики поведения электрона в атоме оказалось недостаточно трех рассмотренных выше квантовых чисел. Изучение структуры спектральных линий показало, что два электрона, имеющие одни и те же значения n, l и m l, т.е. одни и те же энергетические характеристики, ту же форму орбитали и одинаковую ориентацию, могут различаться некоторым особым магнитным свойством, которое обусловливает собственный магнитный момент электрона. Спиновое квантовое число - спин (s или ms). Спин можно рассматривать как результат вращения электрона вокруг собственной оси, которое возможно в двух взаимно противоположных направлениях. Спиновое квантовое число имеет только два значения +½ и -½. Электроны с положительным или отрицательным спинами обозначаются стрелками, направленными соответственно вверх или вниз ↑↓.
Таблица 1 Квантовые числа и максимальное число электронов на энергетических уровнях (n) и подуровнях(l)
В. Паулисформулировал принцип, согласно которому в атоме не может быть 2-х электронов, характеризующихся одинаковым значением 4-х квантовых чисел. Следовательно, каждый электрон в атоме имеет свою собственную энергетическую характеристику, отличающуюся от характеристики другого электрона в этом же атоме. Принцип Паули позволяет определить максимальное число электронов на энергетических уровнях, подуровнях, орбиталях. Из принципа Паули следует, что на каждой атомной орбитали максимально могут находиться только два электрона с противоположно направленными спинами. Два электрона, находящиеся на одной орбитали, т.е. имеющие одинаковые значения квантовых чисел n, l и m l, но различные значения спинового квантового числа, называются спаренными. Электроны, размещенные по одному на орбиталях одного и того же подуровня, называются неспаренными. Например, в состоянии I имеется три неспаренных электрона, в состоянии II имеется два спаренных и два неспаренных, а в состоянии III все электроны спарены:
I II III
Вещества с неспаренными электронами парамагнитны, т.е. эти вещества проводят магнитные силовые линии лучше, чем вакуум, и магнитное поле втягивает эти вещества. Парамагнитны атомы водорода, молекула N2O. Вещества, имеющие спаренные электроны, диамагнитны, т.е. они проводят магнитные силовые линии хуже, чем вакуум, и магнитное поле их выталкивает. Диамагнитны молекулы H2, N2O4, атомы Не, Ar и другие вещества.
|

 :
: , с – скорость света (2,997·108 м/с);
, с – скорость света (2,997·108 м/с);  . (2)
. (2)