Физико-химические основы процесса
дегидратации CaSO4 · 2H2O
Рис. 1.3. Дериватограмма CaSO4 · 2H2O
Первый эндотермический эффект с минимумом при 170°С связан с удалением 3/4 воды из гипса. Второй эндотермический эффект при 180°С менее интенсивен и связан с удалением остального количества кристаллизационной воды, что согласуется с потерей массы на кривой ТГ. При температуре 355°С наблюдается экзотермический эффект, обусловленный образованием нерастворимого ангидрита b - CaSO4 из растворимого. Дальнейшее повышение температуры вплоть до 1200°С не вызывает протекания процессов, связанных с выделением или поглощением теплоты. В интервале температур регистрируется небольшой эндоэффект с минимумом 1200°С, связанный с переходом b - CaSO4 в a - CaSO4. При температуре 1380°С происходит плавление CaSO4 · СаО ранее образовавшегося за счет частичного разложения CaSO4 на СаО и SO2. Этот процесс, связанный с затратой энергии, регистрируется на кривой ДТА в виде эндоэффекта.
1.4.1. Равновесие реакции дегидратации CaSO4 · 2H2O. Качественную оценку влияния технологических параметров на равновесие обратимой эндотермической реакции дегидратации Для количественной характеристики равновесия данной реакции используют термодинамические расчеты, выполняемые согласно уравнению, отражающему зависимость теплоемкости (С р) от температуры.
Значения коэффициентов (а) и (b) приведены в табл. 1.12. Величины энтальпии реакций образования соединений и энергии Гиббса для соединений, участвующих в реакциях обезвоживания гипса, приведены в табл. 1.13.
Таблица 1.12
|

 Как уже отмечалось выше, получение гипсовых вяжущих базируется на обезвоживании дигидрата сульфата кальция по реакции CaSO4 · 2H2O CaSO4 · 0,5H2O + 1,5H2O. На кривой ДТА (рис. 1.3) видны температурные интервалы ступенчатого удаления кристаллизационной воды.
Как уже отмечалось выше, получение гипсовых вяжущих базируется на обезвоживании дигидрата сульфата кальция по реакции CaSO4 · 2H2O CaSO4 · 0,5H2O + 1,5H2O. На кривой ДТА (рис. 1.3) видны температурные интервалы ступенчатого удаления кристаллизационной воды.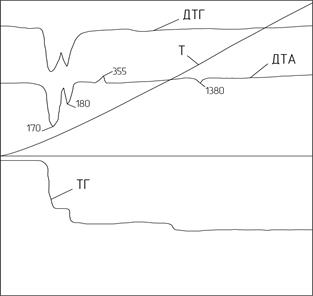
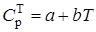 .
.


