Закони справедливі лише для деякої незмінної маси газу.
Внаслідок хаотичного руху та взаємного зіткнення молекул кожна молекула може змінювати свою швидкість як за величиною, так і за напрямом, хоча властивості газу при цьому не змінюються. Дж.Максвелл теоретично розв'язав задачу про розподіл молекул ідеального газу за швидкостями поступального руху (див. малюнок). f( х ) - функція розподілу молекул за швидкостями, при чому
<v>=
Середня квадратична швидкість
Теплові властивості газу характеризуються його теплоємністю, що показує яку кількість теплоти необхідно надати для зміни температури на 1 °С або на 1 K. Оскільки ця величина залежить від умов, при яких йому надається тепло, то розрізняють теплоємності при сталому об'ємі CVта теплоємність при сталому тиску Ср. Причому Ср =С v + R, так як при сталому тиску потрібна додаткова кількість теплоти на виконання роботи по розширенню газу.
Оскільки d, то Су=, С де U — внутрішня енергія газу, і - кількість степенів свободи.
|

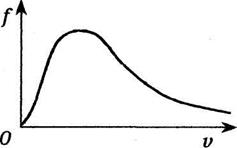
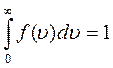
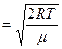 Швидкість, при якій f(U) максимальна, називається
Швидкість, при якій f(U) максимальна, називається найімовірнішою швидкістю
найімовірнішою швидкістю Середня арифметична швидкість
Середня арифметична швидкість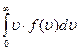 , <v>=
, <v>=  =1.13
=1.13 







