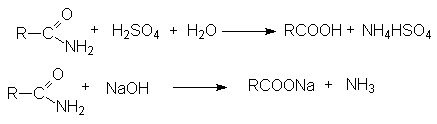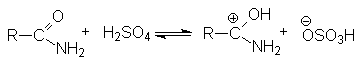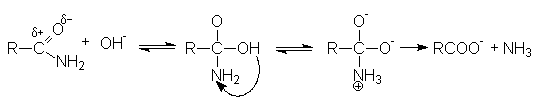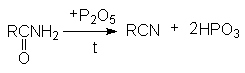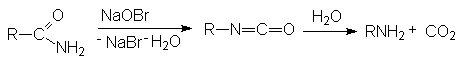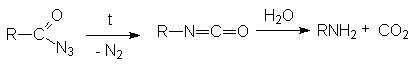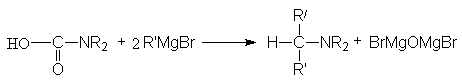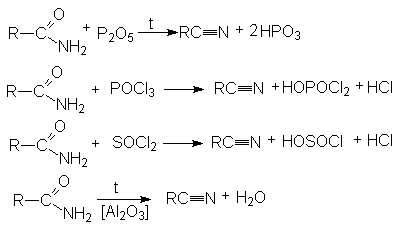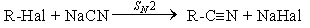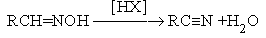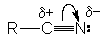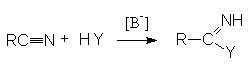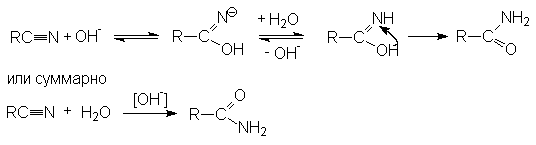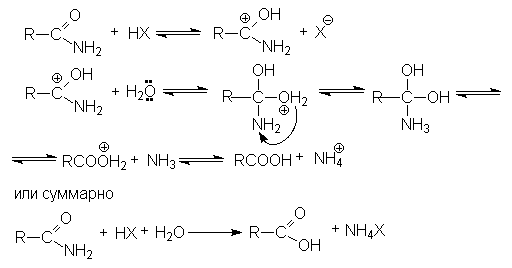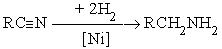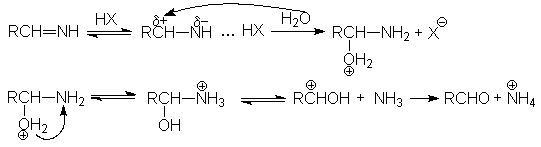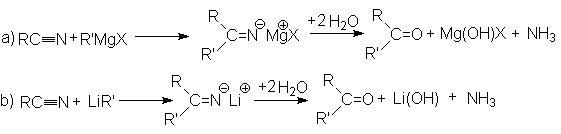Физические свойства амидов. Строение амидной группы.
Амиды представляют собой бесцветные кристаллические вещества или жидкости, растворяющиеся в органических растворителях. Амиды, в молекулах которых имеются связи N-H, ассоциированы вследствие образования межмолекулярных водородных связей и имеют более высокие температуры кипения.
В молекулах амидов имеет место значительное сопряжение неподеленной парой электронов азота и p -электронной системой двойной связи С=О. Это приводит к образованию дополнительной поляризации связей в амидной группе и наличие электрофильных реакционных центров на ацильном и алкильных углеродных атомах и отрицательного - на карбонильном кислороде. Химические свойства амидов.
Активация молекулы амида кислотой связана с ее протонированием и увеличением положительного заряда на карбонильном углероде, который становится более восприимчивым к последующей нуклеофильной атаке:
В случае щелочного гидролиза в качестве нуклеофила вместо воды выступает более реакционно способный гидроксил-анион, который эффективно осуществляет нуклеофильную атаку на кaрбонильный углерод:
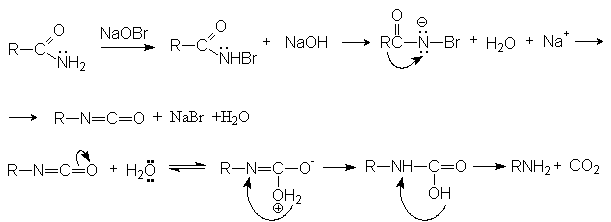
Механизм реакции
Продуктами этой реакции являются альдeгид и третичный амин.
НИТРИЛЫ КАРБОНОВЫХ КИСЛОТ Общая формула нитрилов R-Cº N или CnH2n+1CN. Методы получения нитрилов.
На практике в последнем случае пропускают над катализатором смесь карбоновой кислоты с аммиаком. В этом процессе совмещается образование амида и его дегидратация.
Механизм реакции:
Химические свойства нитрилов. Циано-группа характеризуется высокой степенью поляризации, следствием которой является образование частичного положительного заряда на углероде и отрицательного заряда – на азоте
Это обусловливает, с одной стороны, восприимчивость углеродного центра к нуклеофильной атаке, с другой – основность атома азота.
Примером может служить щелочной гидролиз нитрилов:
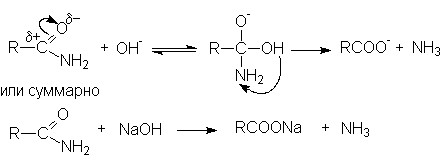
Дальнейший гидролиз амида приводит к образованию солей карбоновых кислот. Таким образом суммарное уравнение щелочного гидролиза нитрилов можно представить как R-Cº N + H2O + NaOH ® RCOONa + NH3 Реакции нитрилов со слабыми нуклеофилами (водой, спиртами) протекает крайне медленно. Для эффективного проведения этих реакций используют кислотный катализ. Активация молекулы нитрила в этом случае осуществляется за счет образования водородной связи между кислотой – катализатором и атомом азота и, как следствие, увеличение положительного заряда на нитрильном углеродном атоме.
На последующей стадии гидролиза кислота НХ выступает одновременно как ускоритель реакции и реагент.
Таким образом, полный кислотный гидролиз нитрилов описывается уравнением: R-Cº N + 2H2O + HX ® RCOOH + NH4X Если в качестве реагента использовать водно-спиртовые среды, то можно осуществлять синтез сложных эфиров R-Cº N + R'OH + H2O + HX ® RCOOR' + NH4X
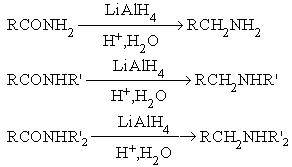
а) каталитическое гидрирование
В качестве катализаторов этих реакций используют металлические Pt, Pd, Ni. б) реагентное гидрирование
В качестве реагентов этих реакциях используют LiAlH4, NaBH4. Механизм реакции: RCº N + LiAlH4 ® RCH=N-Li + AlH3 RCH=N-Li + HX ® RCH=NH + LiX Механизм второй стадии:
Эта реакция является примером присоединения атома углерода к гетероатому (азоту).
Реакция протекает по карбкатионному механизму:
В реакцию вступают только спирты, дающие достаточно стабильные карбкатионы (вторичные, третичные, бензильные и т.п.). Первичные спирты не реагируют. Карбкатионы не обязательно следует генерировать из спирта, его можно получать протонированием алкенов.
ПРОИЗВОДНЫЕ УГОЛЬНОЙ КИСЛОТЫ Угольную кислоту формально можно рассмотреть как карбоновую кислоту, которая вместо углеводородого остатка содержит гидроксильную группу.
Cвойства производных угольной кислоты в основном подобны свойствам производных карбоновых кислот. Отличие от карбоновых кислот состоит в том, что производные угольной кислоты представляют собой результат замещения одной или двух гидроксильных групп.
Поэтому и те и другие являются бифункциональными соединениями. Это открывает допонительные возможности вариации их структуры, а также делает симметричные структуры потенциальным сырьем для получения поликонденсационных полимеров.
Рассмотрим некоторые наиболее важные производные угольной кислоты.
Фосген Хлоругольная кислота
Фосген является устойчивым соединением, хлоругольная кислота неустойчива, известны ее производные, например эфиры.
Фосген получают свободнорадикальным хлорированием оксида углерода (II)
Фосген и эфиры хлоругольной кислоты проявляют свойства хлорангидридов карбоновых кислот, однако в отличие от последних более реакционноспособны в реакциях нуклеофильного замещения. Они являются реагентами для получения эфиров угольной и хлоругольной кислот.
Если в качестве реагента используют фенолы, то результатом является образование диарилкарбонатов.
Фосген является бифункциональным соединением, поэтому его используют для получения пластмасс – поликарбонатов.
Эфиры угольной кислоты
Эти соединения проявляют свойства обычных эфиров карбоновых кислот, в том числе вступают в реакции сложноэфирной конденсации и поэтому используются в органическом синтезе для введения в структуру органических алкоксикарбонильной группы.
Амиды угольной кислоты
Типичным представителем амидов угольной кислоты является мочевина (карбамид)
В промышленности она может быть получена из аммиака и CO2
Процесс проводят при 180-2000С, 18-20 МПа и 100%-ном избытке NH3. Замещенные мочевины могут быть получены взаимодействием фосгена с аминами
Эта реакция осуществляется ступенчато через промежуточное образование карбаминоилхлорида
Можно видеть, что синтез замещенных мочевин требует применение избытка амина. Если реакцию проводить в избытке фосгена, то количественно образуется карбаминоил хлорид (реакция (1)). Последний может быть использован для получения изоцианатов RN=C=O:
причем реакцию проводят в условиях диссоциации гидрохлорида амина, образующегося на стадии (1) и снова вовлекающегося в реакцию (1).
Суммируя реакции (1), (3), (4), имеем стехиометрию процесса синтеза изоцианата
Изоцианаты используют для получения уретанов (эфиров карбаминовой кислоты)
Cами карбаминовые кислоты RNHCOOH, представляющие собой амиды, нестабильны и легко распадаются на амины(аммиак) и CO2
Практическое значение имеют диизоцианаты, образующие при сополимеризации с двухатомными спиртами полиуретаны.
Полиуреаны применяют для получения синтетических волокон, каучуков, клеев и лаков. Из них получают пенопласты, для чего в процессе полимеризации добавляют немного воды, которая гидролизует часть изоцианитных групп с выделением диоксида углерода.
CO2 вспенивает полимер, придавая ему пористую структуру.
Другой способ получения уретанов (карбаматов) – амидирование эфиров хлоругольной кислоты:
Многие эфиры замещенных карбаминовых кислот являются ценными пестицидами, достаточно легко разлагающимися в природных условиях с образованием малотоксичных соединений. Саму мочевину широко используют в сельском хозяйстве как высококачественное удобрение и кормовую добавку. Другие направления использования мочевины – карбамидная депарафинизация и синтез мочевино – формальдегидных смол
|