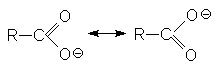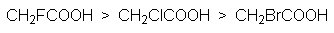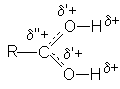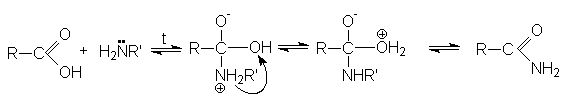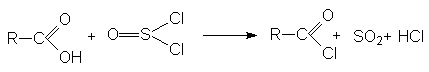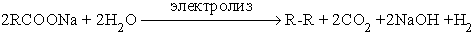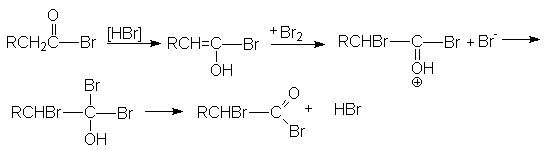Химические свойства карбоновых кислот
Большинство реакций карбоновых кислот может быть отнесено к одному из четырех основных типов: 1.Реакции, сопровождающиеся разрывом О-Н-связей, например, кислотная диссоциация. 2.Реакции по карбонильному углероду, которые имеют нуклеофильный характер. 3.Реакции расщепления 4.Реакции по a -углеродному атому алкильной группы. Кислотность карбоновых кислот По сравнению со спиртами карбоновые кислоты обладают более высокой кислотностью. При этом в растворе реализуется равновесие.
Способность к отдаче к протонам обусловлена двумя факторами: поляризацией связей О-Н в исходном состоянии и стабилизацией карбоксилат-аниона из-за деколализации отрицательного заряда в нем посредством резонанса.
Кислотность карбоновых кислот характеризуется константой кислотности Ка или показателем рКа. Их значения обычно составляет приблизительно 10-5, что свидетельствует о слабости этих кислот. Присутствие в структуре радикала электроноакцепторных заместителей будет стабилизировать карбоксилат анион, что приведет к увеличению кислотности соответствующей ему кислоты. Например: рКа монохлоруксусной кислоты составляет 2,9 а уксусной – 4,8. По мере удаления электроноакцепторного заместителя от карбоксильной группы кислотность снижается, что связано с быстрым затуханием индуктивного эфекта: так рКа b -хлорпропионовой кислоты составляет ~4,0. Наоборот, увеличение разветвления алкильного радикала приводит к снижению кислотности, так как при этом возрастает индуктивный эффект алкильной группы. На основе этих данных можно представить следующие ряды кислотности карбоновых кислот.
Кислотность карбоновых кислот проявляется в их взаимодействии с активными металлами и основаниями. 2RCOOH + 2Na ® 2RCOONa + H2 RCOOH + NaOH ® RCOONa + H2O 2RCOOH + Na2CO3 ® 2RCOONa + H2O + CO2 Основностькарбоновыхкислот В кислой среде (pH<3) диссоциация карбоновых кислот практически не происходит, так как равновесие (1) существенно смещено в левую сторону из-за избытка ионов HSolÅ. В то же время в кислой среде осуществляется протонирование карбоновых кислот по основному карбонильному кислороду.
В протонированной форме оба кислородных атомов становятся одинаковыми:
Несмотря на малую концентрацию протонированной формы присутствие небольших количеств сильных кислот исключительным образом влияет на реакционную способность карбоновых кислот: повышение положительного заряда на карбонильном углероде делает его восприимчивым к атаке нуклеофильными реагентами и открывает возможность для протекания многих реакций нуклеофильного замещения карбоновых кислот. Реакции нуклеофильного замещения
1.Реакции этерификации
В механизме этой реакции ключевую роль играет протонирование карбоновой кислоты кислотой-катализатором.
Реакция этерификации может осуществляться некаталитически, однако для этого требуется жесткие условия процесса. 2. Реакции с N-нуклеофилами (аммиаком, аминами, гидразином и др.). N-нуклеофилы при взаимодействии с карбоновыми кислотами как правило образуют аммониевые соли (карбоксилаты) и только при повышенных температурах происходит присоединение N-нуклеофила к карбонильному углероду.
Механизм реакции согласуется с общепринятыми представлениями о механизме нуклеофильного присоединения азотистых оснований по карбонильной группе:
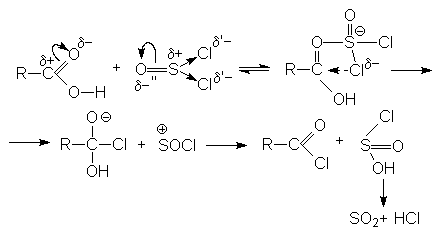
3. Взаимодействие с галогенангидридами хлорорганических кислот (PCl3, PCl5, PBr3, SOCl2).
Механизм реакции связан с концертной атакой электрофильного и нуклеофильного центров карбоновой кислоты молекулой галогенангидрида:
Реакции расщепления 1. Синтез Кольбе (см. подробно методы получения алканов).
2. Пиролиз карбоновых кислот.
3. Реакция Хунсдиккера. RCOOAg + Br2 ® RBr + CO2 + AgBr В качестве объекта декарбоксилирования выступают серебряные или ртутные соли карбоновых кислот, а реагентами являются бром или йод. Предполагают, что промежуточным продуктом этой реакции является гипогалогенит, который распадается на радикалы:
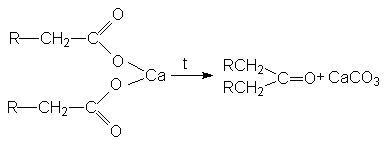
Эту реакцию можно осуществлять без выделения чистых солей ртути или серебра 2RCOOH + HgO + 2Br2 ® 2RBr + HgBr2 + H2O + 2CO2 4. Пиролитическая кетонизация солей карбоновых кислот
Галогенирование по Гелю-Форгальду-Зелинскому Эта реакция является примером взаимодействия по a -углеродному атому по отношению к карбоксильной группе. Реакция бромирования протекает энергично и с хорошим выходом в присутствии небольших количеств фосфора.
Функция фосфора состоит в образовании трехбромистого фосфора, который, реагируя с кислотой, дает ацилбромид. Последний гораздо легче подвергается енолизации по сравнению с исходной кислотой. Бром по видимому реагирует с енолом ацилбромида так же как с енолами кетонов. 2P + 3Br2 ® 2PBr3 RCH2COOH + PBr3 ® RCH2COBr + POBr + HBr
Регенерация исходного ацилбромида осуществляется за счет взаимодействия полученного монобромацилбромида с исходной кислотой.
Хлор в присутствии следов фосфора реагирует аналогичным образом, но в целом менее селективно, поскольку конкурентно может происходить свободнорадикальное хлорирование во все положения углеродной цепи. Взаимодействие с электрофильными реагентами Атомы кислорода карбонильной группы недостаточно заряжены, чтобы быть объектом электрофильной атаки со стороны слабых и умеренных электрофильных реагентов. Для осуществления эффективной реакции электрофильного замещения по карбонильному углероду карбоксильной группы активируют, переводя ее карбоксилат – ионную форму. Тогда можно осуществить реакцию алкилирование, ацилирования и др.
Реакции восстановления карбоновых кислот В целом карбоновые кислоты с трудом поддаются восстановлению как путем каталитического гидрирования, так и при действии натрия в спирте, но восстановление до первичных спиртов при действии литийалюминийгидрида или натрийборгидрида протекает достаточно энергично. 4RCOOH + 3LiAlH4 ® [(RCH2O)4Al]Li + 4H2 + 2LiAlO2 [(RCH2O)4Al]Li + 3H2O + HCl ® RCH2OH + Al(OH)3 + LiCl
|