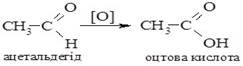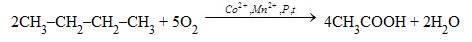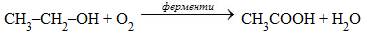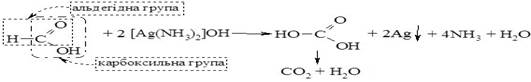Способи добування карбонових кислот
1. Реакції окиснення. Карбонові кислоти одержують шляхом окиснення первинних спиртів та альдегідів. У випадку спиртів спочатку утворюються альдегіди, подальше окиснення яких веде до кислот:
2. Мурашину кислоту в промисловості одержують взаємодією карбон (ІІ) оксиду з натрій гідроксидом при підвищених температурі та тиску (спосіб запропонував П. Бертло у 1855 р.): 1) натрій форміат мурашина кислота 2) Каталітичне окиснення метану 2CH4 + 3O2 → 2H-COOH + 2H2O Вільну кислоту виділяють дією на її натрієву сіль хлоридною або сульфатною кислотою. 3. Оцтову кислоту у промисловості одержують в основному окисненням ацетальдегіду або н-бутану. Ацетальдегід одержують з ацетилену за реакцією Кучерова, який у свою чергу одержують піролізом метану. Окиснення альдегіду проводять у розчинах за наявності солей мангану, як окисник використовують кисень або повітря:
Окиснення н-бутану проводять у розчині оцтової кислоти: 1) 2) Взаємодія карбон(ІІ) оксиду з метанолом: CH3OH + CO → CH3COOH Поряд з оцтовою кислотою у цій реакції утворюється корисні побічні продукти: мурашина та пропіонова кислоти, естери оцтової кислоти та ін. Оцет для харчової промисловості одержують оцтовокислим бродінням етанолу:
4. Бензойну кислоту в лабораторії та промисловості одержують окисненням толуену:
5. Фізичні та хімічні властивост Перші три члени гомологічного ряду насичених монокарбонових кислот — мурашина, оцтова, пропіонова — рухливі рідини з різким запахом, змішуються з водою у будь-яких пропорціях. Члени від 4-го до 9-го — оліїсті рідини з різким неприємним запахом, погано розчинні у воді. Наступні члени гомологічного ряду — тверді речовини без запаху, нерозчинні у воді, але добре розчиняються в органічних розчинниках (етері, бензені). Кислоти мають вищі, порівняно з відповідними спиртами, температури кипіння. Це зумовлено міцними водневими зв’язками між парами молекул кислоти й утворенням стабільних асоціатів, димерів, які розпадаються лише за високої температури. Наприклад, понад 250 °С — для ацетатної кислоти. Розчинність карбонових кислот у воді зумовлена виключно наявністю карбоксильної групи, що утворює водневі зв’язки з молекулами води.
Хімічні властивості карбонових кислот Карбонові кислоти проявляють всі властивості характерні для неорганічних кислот і є слабкими електролітами. 1) Дисоціація у водних розчинах: CH3COOH = CH3COO- + H+ Кислотний залишок називається ацетат-іоном. 2) Взаємодія з основами: СH3COOH + NaOH → CH3COONa + H2O; 3) Взаємодія з основними оксидами: 2СH3COOH + Na2O → 2CH3COONa + H2O; 4) Взаємодія з солями слабкіших кислот: 2СH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2; Властивості, характерні для карбонових кислот: 5) Взаємодія з галогенами: СH3COOH +Cl2 → CH2ClCOOH + HCl хлороцтова кислота Одержана хлороцтова кислота сильніша за оцтову. 6) Взаємодія зі спиртами:
Утворюються складні естери. Цей естер називається етилацетат, або етиловий естер оцтової кислоти. 2. утворення складних ефірів (реакція етерифікації) у присутності каталізатора - сульфатної кислоти:
Зворотна реакція називається омиленням або гідролізом складного ефіру. Численні естери карбонових кислот та насичених спиртів мають приємний запах і часто зустрічаються у рослинах, надаючи аромату квітам, плодам та ягодам. Деякі естери одержують синтетичним шляхом і під назвою “фруктових есенцій” широко застосовують у кондитерській промисловості та виробництві прохолоджувальних напоїв, як смакові добавки, а також у парфумерії. 4. Утворення амідів. Взаємодія карбонових кислот з амоніаком призводить до утворення солей амоніаку, які при нагріванні відщеплюють молекулу води і перетворюються в аміди карбонових кислот:
6. Біологічна роль монокарбонових кислот
Кислий смак плодів, листя багатьох рослин обумовлений наявністю різноманітних карбонових кислот, назви яких свідчать про місцезнаходження: щавлевої, яблучної, виноградної, лимонної. Мурашина кислота (метанова) НСООН – перший член гомологічного ряду карбонових кислот, найпростіша карбонова кислота. Це – рідина з різким запахом, вперше виділена у XVI ст. із мурах (Рей, 1670 р.) за що і одержала свою назву. Мурашина кислота входить до складу та зумовлює пекучі властивості кропиви (кропива “пече”). Мурашина кислота завдяки структурним особливостям (в її молекулі можна виділити альдегідну та карбоксильну групи), виявляє властивості альдегідів та карбонових кислот. Так, вона дає реакцію “срібного дзеркала”, яка є якісною на мурашину кислоту і дозволяє відрізнити її від інших карбонових кислот:
Мурашину кислоту використовують в органічному синтезі (для одержання розчинників), як відновник, при фарбуванні тканин, 1,25% розчин застосовують у медицині під назвою “мурашиний спирт” як місцево-анестезуючий засіб. Оцтова кислота (етанова) СН3СООН – безбарвна рідина з характерним запахом. Оцтова кислота відома з давніх часів у вигляді розбавленого водного розчину – оцту (гр. кислий). Одержували оцтову кислоту спочатку перегонкою оцту, потім – сухою перегонкою деревини. У 1831 р. Г. Деві та Е. Деберейнер синтезували її пропускаючи пари етанолу над розпеченою губчатою платиною. Структурну формулу оцтової кислоти запропонував Кольбе у 1858 р. Основну масу оцтової кислоти, яку добувають у промисловості, використовують у харчовій промисловості для виготовлення оцтової есенції (70 ‑ 80% водний розчин кислоти) та оцту (9% водний розчин), а також у техніці для синтезу її похідних (естерів, амідів, ангідриду) та дабування численних барвників, лікарських засобів тощо. Безводну оцтову кислоту застосовують як розчинник органічних речовин. Бензойна кислота (бензенкарбонова) С6Н5СООН – найпростіша ароматична карбонова кислота. Безбарвна кристалічна речовина, вперше виділена з природної, так званої бензойної, смоли. У 1814 р. Берцеліус встановив її склад. Окиснення гомологів бензену до бензойної кислоти проведене у 1872 р. Поповим та Цинке. Здавна відомі антисептичні властивості бензойної кислоти, завдяки чому її використовують у виробництві лікарських засобів. Використовують для виготовлення барвників та пахучих речовин. Натрій бензоат застосовують при консервуванні продуктів.
|