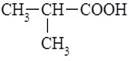Загальна характеристика карбонових кислот
Карбонові кислоти – похідні вуглеводнів, що містять одну або декілька карбоксильних груп:
Карбоксильна група або карбоксил складається із карбоніл ьної (>С=О) та гідро ксильної (–ОН) груп. Назва “карбоксильна” утворена шляхом поєднання назв груп: “карбонільна” та “гідроксильна”. Електронна густина у карбонільній групі зміщена до Оксигену, внаслідок чого він набуває часткового негативного заряду δ-, а атом Гідрогену гідроксильної групи отримує ще більший (порівняно зі спиртами) частковий позитивний заряд δ+ і більшу рухомість. Завдяки чому водневі зв’язки між молекулами карбонових кислот виявляються сильнішими і в розчинах вони існують переважно у вигляді димерів. З другого боку, електронна густина з а-атома Карбону алкільного замісника зміщується до карбоксильного атома Карбону. Унаслідок цього атоми Гідрогену біля а-атома Карбону також набувають більшої рухливості, що дає їм змогу заміщуватись на атоми галогенів. Назва “карбонові кислоти” утворилась від латинської назви карбонатної кислоти – Acidum carbonicum. Сполуки цієї групи розглядали як похідні карбонатної кислоти, в молекулі якої один гідроксил заміщений на атом Гідрогену або інший радикал:
Залежно від кількості карбоксильних груп, що входять до складу молекули карбонової кислоти розрізняють моно-, ди-, три- і т.д. карбонові кислоти. Кількість карбоксильних груп визначає основність кислоти. Монокарбонові кислоти, які розглянуті нижче, містять одну карбоксильну групу. Їх загальна формула: R–COOH. Залежно від природи радикалу, з яким сполучена карбоксильна група, карбонові кислоти поділяють на аліфатичні та ароматичні. Похідні карбонових кислот, які можна одержати шляхом хімічних перетворень карбоксильної групи називають функціональними похідними. До них належать естери
2. Класифікація карбонових кислот
1) залежно від кількості карбоксильних груп (основності): • монокарбонові (однооснбвні): НСООН мурашина (метанова) кислота СН3СООН оцтова (ацетатна, етанова) кислота • дикарбонові (двохосновні): НООС—COОH щавлева кислота НООС-СН2-СООН малонова кислота • трикарбонові (трьохосновні):
2) залежно від природи вуглеводневого замісника, сполученого з карбоксильною групою: • насичені: СН3-СН2-СООН пропанова кислота • ненасичені: СН2=СН-СООН акрилова кислота
• аліциклічні:
• ароматичні:
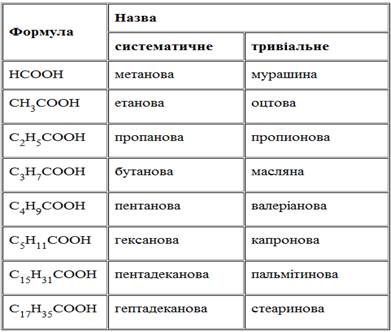
3) залежно від кількості атомів Карбону в алкільному заміснику: • нижчі (низькомолекулярні): Н-СООН метанова кислота СН3-СООН етанова кислота С2Н5-СООН пропанова кислота С3Н7-СООН бутанова кислота • вищі (високомолекулярні): С15Н31-СООН пальмітинова кислота С17Н29-СООН ліноленова кислота С17Н31-СООН лінолева кислота С17Н33-СООН олеїнова кислота С17Н35-СООН стеаринова кислота
3. Номенклатура та ізомерія Для карбонових кислот зазвичай використовують тривіальні назви, які найчастіше вказують на джерело їх добування. Так, мурашину кислоту вперше виділили із мурах, оцтову – із оцту, масляну – з прогірклого масла. Тривіальні назви настільки сильно вкоренились, що для назв солей, естерів цих кислот використовують відповідні латинські корені – форміат, ацетат, бутират тощо. За замісниковою номенклатурою ІЮПАК назви монокарбонових кислот утворюють від назв вуглеводнів з тією ж кількістю атомів Карбону у головному карбоновому ланцюгу, додаючи закінчення –ова та слово “кислота”. Нумерацію атомів починають з атома Карбону карбоксильної групи.
Деякі насичені одноосновні кислоти
Аліфатичні карбонові кислоти з кількістю атомів Карбону більше шести відносять до вищих карбонових кислот, вони можуть бути насиченими або ненасиченими. Для карбонових кислот характерна структурна ізомерія, зумовлена різною будовою карбонового радикалу. Вона можлива починаючи з четвертого члена гомологічного ряду. Існує дві кислоти з чотирма атомами Карбону: масляна та ізомасляна, назва останньої показує що її молекула містить розгалужений ланцюг: СН3–СН2–СН2–СООН масляна кислота ізомасляна кислота Зі зростанням кількості атомів Карбону в молекулі кислоти, кількість структурних ізомерів зростає.
|


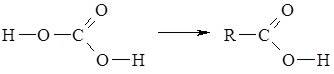
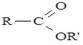 , аміди
, аміди 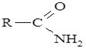 тощо.
тощо.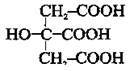 лимонна кислота
лимонна кислота циклогексан-1,4- дикарбонова кислота
циклогексан-1,4- дикарбонова кислота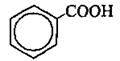 бензойна кислота
бензойна кислота