РЕАКЦИЙ 1 страница
ВИДЫ ОРГАНИЧЕСКИХ РЕАГЕНТОВ И РЕАКЦИЙ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Х.К.ГАДЕЛЕВА, Р.А.ЗАЙНУЛЛИН,
ВИДЫ ОРГАНИЧЕСКИХ РЕАГЕНТОВ И РЕАКЦИЙ
Уфа 2006
УДК 547.541 ББК 24.2 Г 17
ВИДЫ органических реагентов и реакций: Учеб. пособие/ Х.К.Гаделева, Р.А.Зайнуллин; Башк. гос. унив-т. Уфа, 2006, 63 с. ISBN
Приведена классификация реагентов и органических реакций. Рассмотрены современные представления о направлениях и механизмах реакций присоединения, циклоприсоединения, полимеризации, замещения, элиминирования. Достаточное внимание уделено реакциям окисления и восстановления основных классов органических соединений.
Библиогр.:17 назв.
СОДЕРЖАНИЕ
1. КЛАССИФИКАЦИЯ РЕАГЕНТОВ
В зависимости от того, какие свойства выражены более ярко - электронодонорные или электроноакцепторные - реагенты подразделяются соответственно на нуклеофильные и электрофильные. Частица, являющаяся нуклеофилом, должна иметь пару электронов, которую она может предоставить другому атому. Очевидно, что чем сильнее атом удерживает электронную пару, тем меньше вероятность того, что он сможет действовать в качестве нуклеофила. К нуклеофильным реагентам относятся анионы и нейтральные соединения, содержащие атомы с неподеленными парами электронов, т.е. основания Льюиса. Нуклеофильные реагенты можно классифицировать в зависимости от типа нуклеофильного атома. Например:
(М - это металл).
Электрофильными реагентами называют частицы с электроноакцепторными свойствами, которые образуют связь, акцептируя оба электрона партнера. В соответствии с классификацией Льюиса, такие реагенты рассматриваются как кислоты. К электрофильным реагентам относят катионы, а также нейтральные соединения, содержащие атомы с незаполненной орбиталью. В зависимости от типа электрофильного атома эти реагенты подразделяют на: Н-электрофилы: Н+Х- (сильные кислоты), С-электрофилы: R3C+X- (карбкатионы), соединения с сильнополярной связью R3C+d-X-d, R-CºN, N-электрофилы: соли диазония Ar-N+ºNX-, О-электрофилы: R-O+d-X-d, R-O-O-R. Некоторые реагенты могут проявлять как электрофильные, так и нуклеофильные свойства. Например, галогены в реакциях присоединения по кратной углерод-углеродной связи за счет наличия свободных d-орбиталей выступают как электрофильные реагенты. Однако в реакции: Cl2 + AlCl3 ® Cl+AlCl4- молекула хлора выступает как нуклеофильный реагент вследствие наличия у каждого атома хлора неподеленных электронных пар.
2. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
Классификация реакций проводится по характеру химических превращений, а также по способу разрыва и образования связей. По характеру химических превращений различают реакции присоединения, циклоприсоединения, полимеризации, отщепления (элиминирования), замещения, изомеризации и перегруппировок, окисления, восстановления, конденсации. По способу разрыва и образования химической связи реакции подразделяются на ионные (гетеролитические) и радикальные (гомолитические). При гетеролитическом образовании связи один из атомов, между которыми она образуется, предоставляет пару электронов, а второй - свободную орбиталь: A :- + В+ ® А - В Соответственно гетеролитический разрыв связи происходит следующим образом: А: В ® А:- + В+
При гетеролитическом образовании связи атом, имеющий пару электронов, называют нуклеофильным и реакции с участием таких реагентов рассматриваются как реакции нуклеофильного замещения, присоединения, отщепления. Частица, предоставляющая свободную орбиталь для образования связи, называется электрофильной, и реакции с участием таких реагентов рассматриваются как электрофильные. Известны процессы, в которых происходит одновременный разрыв и образование нескольких связей за счет согласованного перемещения электронов в циклическом комплексе. Такие процессы называют согласованными или многоцентровыми процессами. Примером таких процессов служат реакции Дильса-Альдера, рассмотренные в разделе 4. В настоящее время показано, что передача пары электронов для образования связи может проходить в две стадии. Первоначально один из атомов передает один электрон и образуются ион-радикалы. Затем происходит образование связи за счет спаривания электронов:
А: + В ® А×+ + В×- ® А-В
Такие процессы называют реакциями одноэлектронного переноса. По сути, это окислительно - восстановительные реакции. При гомолитическом образовании связи каждый из атомов предоставляет один электрон: А× + В×® А - В
Гомолитический разрыв связи происходит следующим образом:
А: В ® А× + В×
В органических соединениях между атомами реализуются, как правило, s- и p-связи. В зависимости от того, с каким атомом связан углерод непосредственно, а также от влияния близлежащих атомов, указанные связи могут быть полярными, неполярными и малополярными. Например:
Органические соединения, в молекуле которых все связи являются s-связями, вступают в реакции замещения. Характер разрыва s-связи (гомолитический или гетеролитический) зависит от ее полярности. Если s-связи неполярны или малополярны, то происходит гомолитический разрыв связей и соединение вступает в реакции радикального замещения. В случае, когда s-связь полярна, ее разрыв происходит гетеролитически, а замещение идет по ионному механизму. Реакции, сопровождающиеся гетеролитическим разрывом и образованием ковалентных связей, по типу реагента можно подразделить на нуклеофильные и электрофильные. Ненасыщенные органические соединения, т.е. содержащие p-связи, вступают в реакции присоединения по месту разрыва p-связей. В данном случае характер присоединения (радикальный или ионный) определяется полярностью p-связи и природой атакующего агента. Рассмотрим примеры различных типов реакций и их механизмы.
3. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
3.1. Электрофильное присоединение к алкенам
Такие реагенты, как галогены (Cl2, Br2, J2), галогенводороды (HCl, HBr), хлорноватистая и бромноватистая кислоты, вода, серная кислота присоединяются к двойным связям алкенов, образуя насыщенные соединения:
Приведенные реакции протекают по механизму электрофильного присоединения. Они начинаются с атаки катионом или положительно заряженным концом реагента поляризованной связи p-электронов двойной связи, после этого следует атака нуклеофилом образовавшегося карбкатиона. Рассмотрим механизмы реакций присоединения брома, воды, хлористого водорода к алкенам. Под действием углерод-углеродной p-связи молекула брома поляризуется. Атом брома, получивший при этом частично положительный заряд, реагирует с p-системой, образуя неустойчивый p-комплекс. Далее p-комплекс разрушается и образуется s-комплекс. Затем нуклеофил (Br-) атакует образовавшийся карбкатион. Продуктом подобных реакций являются вицинальные дигалогениды:
p-комплекс
Реакция гидратации алкена начинается с его протонирования. Образующийся при этом катион реагирует с молекулой воды и дает О-протонированный спирт. На последней стадии вторая молекула воды отрывает протон и образуется спирт:
Изучая ориентацию присоединения Н-электрофилов к несимметрично построенным алкенам, В.Марковников в 1869 г. установил следующую закономерность: присоединение НХ к несимметричной двойной связи происходит таким образом, что водород от НХ направляется к тому атому углерода, который несет наибольшее число атомов водорода (к наиболее гидрогенизированному углеродному атому). Например, взаимодействие пропилена с хлористым водородом протекает по схеме:
На первой стадии реакции, наряду с карбкатионом (I) образуется небольшое количество карбкатиона (II). У иона (I) заряд находится у среднего атома углерода, связанного с двумя метильными радикалами. У иона (II) заряд сосредоточен у крайнего углеродного атома, связанного с одним радикалом - этилом. Учитывая +I-эффекты алкильных радикалов, можно утверждать, что карбкатион (I) более устойчив, чем карбкатион (II), т.к. у иона (I) положительный заряд нейтрализуется двумя метильными группами, а у катиона (II) за счет +I-эффекта только одной алкильной (т.е. этильной) группы. Следовательно, образование катиона (I) будет идти много быстрее образования катиона (II). В результате после присоединения аниона хлора галогенпроизводное с галогеном у среднего атома углерода (Ш) образуется в количестве 90 % от общего выхода, а галогенпроизводное (IV) в количестве лишь 10 %.
3.2. Нуклеофильное присоединение по карбонильной группе
3.2.1. Взаимодействие карбонильных соединений с азотсодержащими нуклеофильными реагентами
Это реакции аммиака, первичных и вторичных аминов, гидроксиламина, гидразина и его производных с альдегидами и кетонами. Механизм реакции рассмотрим на примере взаимодействия оксосоединений с первичными аминами:
Реакции почти всегда заканчиваются отщеплением молекулы воды от продуктов присоединения и образованием иминов (оснований Шиффа):
По аналогичному механизму идет образование оксимов, гидразонов, азинов, фенилгидразонов и др. Оксимы образуются в результате взаимодействия карбонильных соединений с гидроксиламином:
Продуктом взаимодействия карбонильных соединений с гидразином являются гидразоны или азины:
При взаимодействии с фенилгидразином карбонильные соединения образуют фенилгидразоны:
3.2.2. Присоединение С-нуклеофилов к карбонильным соединениям
3.2.2.1. Взаимодействие оксосоединений с металлоорганическими соединениями
Присоединение металлоорганических соединений к альдегидам и кетонам протекает по схеме:
Эти реакции широко используются для получения спиртов. При присоединении к формальдегиду реактива Гриньяра (R-MgX) образуются первичные спирты, к другим альдегидам - вторичные, а к кетонам - третичные спирты:
ацетон
3.2.2.2. Реакции конденсации
На первой стадии этих реакций происходит отрыв протона С-Н-кислоты с образованием карбаниона, выступающего далее в роли нуклеофильного реагента. На второй стадии происходит присоединение нуклеофила к карбонильной группе.
а) альдольно-кротоновая конденсация
При конденсации оксосоединений в реакцию вовлекаются одновременно a-метиленовая компонента одной молекулы и оксогруппа второй молекулы. Альдегиды вступают в эти реакции значительно легче, чем кетоны - под влиянием слабой щелочи или разбавленной кислоты. Из двух молекул ацетальдегида получается 3-гидроксибутаналь по схеме:
Из ацетона при альдольной конденсации получается диацетоновый спирт:
В более жестких условиях от продуктов этих реакций отщепляется молекула воды (кротоновая конденсация) и образуются непредельные оксосоединения:
Конденсации типа альдольной или кротоновой могут происходить не только между одинаковыми, но и разными молекулами оксосоединений. Формальдегид, не имеющий a-звена, не вступает в реакции этого типа. С другими же соединениями формальдегид конденсируется, предоставляя всегда оксогруппу. Оксогруппа альдегида активнее, чем у кетона, поэтому при конденсации альдегидов с кетонами карбонильная группа альдегида всегда присоединяет элементы a-звена кетона.
б) реакция Кневенагеля
Алифатические и ароматические альдегиды в присутствии оснований конденсируются с малоновой кислотой, ее эфирами и другими соединениями, содержащими метиленовую группу, активированную карбонильной, нитрильной или нитрогруппой:
В качестве катализатора Кневенагель использовал аммиак, первичные и вторичные амины.
в) конденсация с алкинами
В реакцию с оксосоединениями могут вступать и другие соединения, имеющие подвижный атом водорода, например, ацетиленовые углеводороды. Реакция кетонов с алкинами идет в присутствии порошкообразного едкого кали:
Таким способом можно получить третичные спирты с этинильным радикалом. Промышленную реализацию нашла реакция ацетилена с формальдегидом, которая приводит, в зависимости от соотношения компонентов, к пропаргиловому спирту или 2-бутин-1,4-диолу:
Конденсацией ацетона с ацетиленом получают диметилэтинилкарбинол. Эта реакция является первой стадией в синтезе изопрена по способу Фаворского:
3.2.3. Присоединение О-нуклеофилов
Это реакции присоединения воды, спиртов и др. Вода и алканолы являются слабыми нуклеофилами и поэтому реакция идет только с очень активными или активированными вследствие кислотного катализа карбонильными соединениями. Например, формальдегид в водных растворах находится в гидратированной форме:
При присоединении к хлоралю воды образуется хлоральгидрат, используемый в медицине как снотворное:
В реакции альдегидов с алканолами получаются полуацетали, которые в избытке алканола превращаются в ацетали:
3.3. Реакции свободнорадикального присоединения
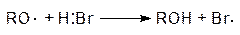
В разделе 3.1. были рассмотрены примеры реакций присоединения к несимметрично построенным олефинам. Закономерности присоединения определяются правилом Марковникова: при присоединении галогенводородов протон присоединяется к наиболее гидрогенизированному атому углерода. Однако в присутствии перекисных соединений присоединение HBr происходит против правила Марковникова. Это изменение направления присоединения в присутствии пероксидов называется перекисным эффектом Хараша. В этих условиях присоединение идет не по ионному механизму, который обсуждался в разделе 3.1, а по свободнорадикальному. На начальной стадии (инициирование) происходит разложение пероксида (1). Образовавшиеся свободные радикалы отщепляют водород от HBr, образуя радикал брома (2), который присоединяется к олефину (в реакции, протекающей по ионному механизму, сначала к олефину присоединяется протон) и превращает его в свободный радикал (3). Последний отщепляет водород от бромистого водорода и вновь генерируется радикал брома (4). Схема реакции:
Направление присоединения радикала брома на стадии (3) определяется легкостью образования и устойчивостью свободных радикалов, которые уменьшаются в следующем порядке: третичный > вторичный > первичный, т.е. увеличение числа алкильных заместителей при радикальном центре приводит к увеличению его стабильности. Например, при свободнорадикальном присоединении бромистого водорода к пропилену образуется н-пропилбромид, поскольку вторичный свободный радикал образуется быстрее и он более устойчив, чем первичный:
По свободнорадикальному механизму может идти реакция присоединения галогенов (Cl2, Br2) к олефинам. Эти реакции протекают быстрее, чем соответствующее ионное присоединение, но требуют присутствия инициатора. Реакция может инициироваться светом. Схема реакции:
В разделе 5 приведены примеры реакций свободнорадикального полиприсоединения (полимеризации).
4. РЕАКЦИИ ЦИКЛОПРИСОЕДИНЕНИЯ
В разделах 3, 5, 6 рассмотрены примеры гетеролитических и гомолитических реакций. Однако существуют процессы, в которых происходит одновременное изменение состояния нескольких связей. К таким процессам относятся реакции циклоприсоединения. Наиболее изученными и распространенными среди реакций циклоприсоединения являются реакции Дильса-Альдера (диеновый синтез). Общая схема реакций такого типа:
диен диенофил диен диенофил
Подобным образом реагируют многие сопряженные диены (диеновый компонент) с ненасыщенными соединениями (диенофилами), образуя шестичленные циклические соединения, содержащие двойную связь. Необходимым условием протекания реакции является то, что диен должен быть в цисоидной конформации. Только в этом случае диенофил взаимодействует с обоими концами диена (в 1,4-положения) одновременно. В случае трансоидной конформации диена диенофил не может одновременно столкнуться с обоими концами диена:
Это объясняет, почему диены типа или
|



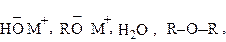
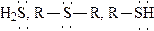


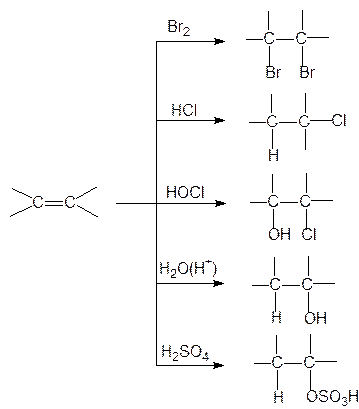


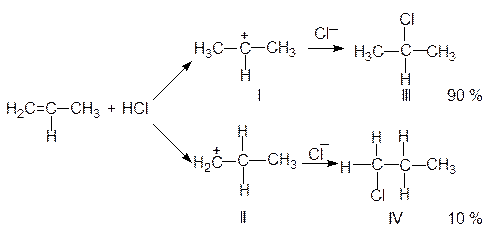
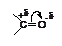 В карбонильной группе >С=О атомы углерода и кислорода двоесвязаны, т.е. связаны s- и p-связями. Одна из связей (p) более поляризуема, чем другая (s), что схематически выражают следующим образом:. Смещение электронной плотности связано с различной электроотрицательностью атомов, образующих карбонильную группу, а именно, более высокой электроотрицательностью атома кислорода. С наличием на углеродном атоме частичного положительного заряда связана большая часть химических свойств альдегидов и кетонов. Это сказывается, во-первых, в способности карбонильных соединений вступать в реакции нуклеофильного присоединения, во-вторых, в способности водородных атомов соседнего с карбонильной группой звена к протонизации, т.е. удалению из молекулы в виде протона под действием основных агентов. Чем больше положительный заряд на атоме углерода карбонильной группы, тем больше скорость взаимодействия карбонильного соединения с нуклеофильными реагентами. Введение электроноакцепторных заместителей в молекулу карбонильного соединения увеличивает этот заряд, и, следовательно, приводит к росту скорости реакции.
В карбонильной группе >С=О атомы углерода и кислорода двоесвязаны, т.е. связаны s- и p-связями. Одна из связей (p) более поляризуема, чем другая (s), что схематически выражают следующим образом:. Смещение электронной плотности связано с различной электроотрицательностью атомов, образующих карбонильную группу, а именно, более высокой электроотрицательностью атома кислорода. С наличием на углеродном атоме частичного положительного заряда связана большая часть химических свойств альдегидов и кетонов. Это сказывается, во-первых, в способности карбонильных соединений вступать в реакции нуклеофильного присоединения, во-вторых, в способности водородных атомов соседнего с карбонильной группой звена к протонизации, т.е. удалению из молекулы в виде протона под действием основных агентов. Чем больше положительный заряд на атоме углерода карбонильной группы, тем больше скорость взаимодействия карбонильного соединения с нуклеофильными реагентами. Введение электроноакцепторных заместителей в молекулу карбонильного соединения увеличивает этот заряд, и, следовательно, приводит к росту скорости реакции.
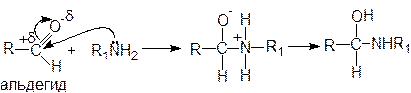
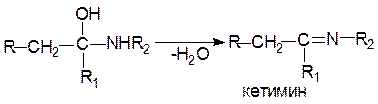
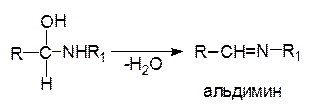
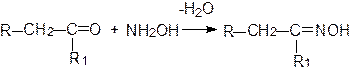
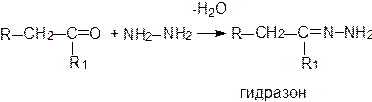
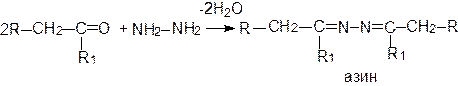
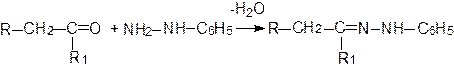
 По механизму нуклеофильного присоединения по карбонильной группе идут реакции с металлоорганическими соединениями со связью углерод-металл различной полярности: R2-dM+d R2:-+ M+, а также многие реакции конденсации карбонильных соединений в щелочной среде.
По механизму нуклеофильного присоединения по карбонильной группе идут реакции с металлоорганическими соединениями со связью углерод-металл различной полярности: R2-dM+d R2:-+ M+, а также многие реакции конденсации карбонильных соединений в щелочной среде.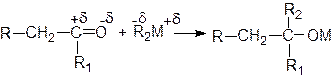
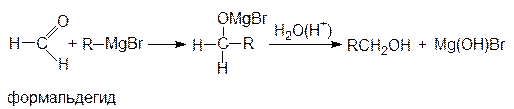
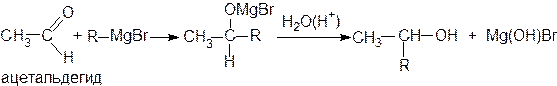
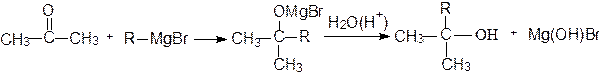

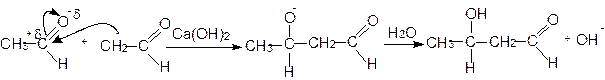
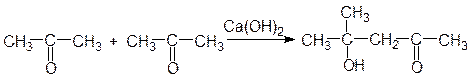
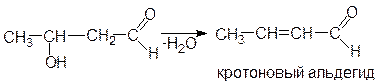
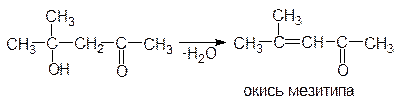
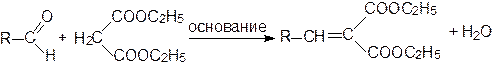
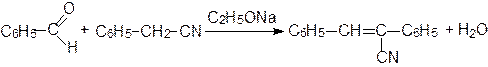
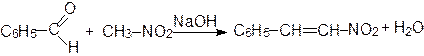
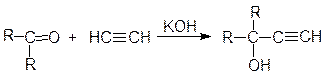
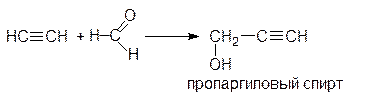
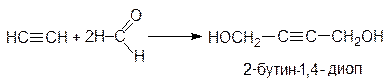

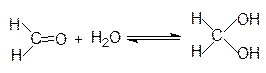
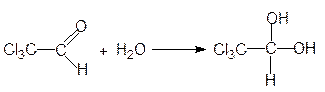
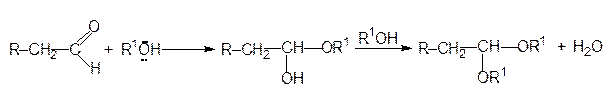
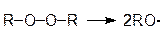
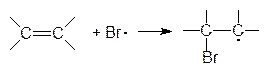
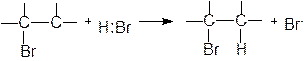
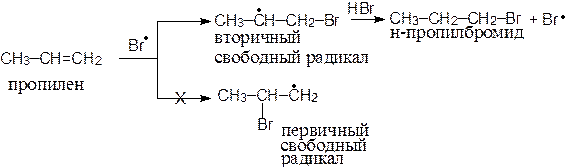
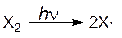
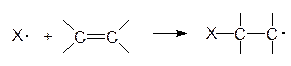
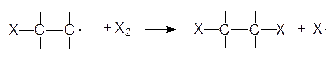
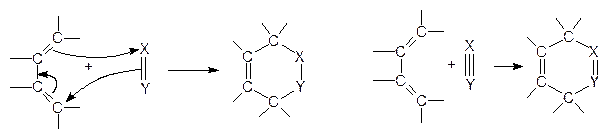

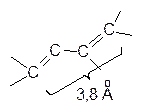

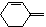 не применяются в качестве диеновых компонентов в реакции Дильса-Альдера. С наиболее реакционноспособными диенофилами в реакцию Дильса-Альдера вступают и некоторые гетероциклические соединения, например, фуран, образуя бициклические соединения.
не применяются в качестве диеновых компонентов в реакции Дильса-Альдера. С наиболее реакционноспособными диенофилами в реакцию Дильса-Альдера вступают и некоторые гетероциклические соединения, например, фуран, образуя бициклические соединения.


