Ізопроцеси в газах.
План
3. Внутрішня енергія та теплоємність ідеального газу.Перший закон термодинаміки. 4. Рівняння адіабати.. 5. Політропічні процеси. 6. Робота ідеального газу при різних процесах.
1. Рівняння стану ідеального газу. Стан будь – якої заданої маси газу визначається за допомогою макропараметрів: · тиск р, · об’єм V, · температура Т Ці параметри пов’язані між собою. Співвідношення, що визначає зв’язок між параметрами будь-якого тіла називають рівнянням стану. Розглянемо ідеальний газ. Використаємо основне рівняння МКТ:
Величина Відповідне рівняння
Ізопроцеси в газах. Процес — це послідовна зміна станів або розвинення деякого явища. (Процес відбувається, протікає; явище виникає в результаті процесу, спостерігається). Ізопроцеси — це такі процеси, що відбуваються при сталості одного з параметрів стану. Ізотермічний процес (розширення або стиснення газу при Т=const: У цилиндрі під поршнем — повітря в об'ємі V1 при p1 і T1.
Повільним підняттям поршня
При Т2 = Т1 тиск p2 <р1 По Клапейрону:
Ізобарний процес
Розширення газу від V1 до V2 — результат нагрівання. Тиск залишається сталим лише у випадку, якщо ефект зменшення густини ударів молекул об поверхню циліндра компенсується збільшенням енергії окремих ударів: у скільки разів збільшиться V, у стільки разів повинно зрости Т, щоб р = const.
У скільки разів збільшиться Т, у стільки разів зросте р:
Закон Шарля з використанням температури по Цельсію
3. Внутрішня енергія та теплоємність ідеального газу. Перший закон термодинаміки. Термодинамічною системою називають систему макроскопічних тіл, що можуть взаємодіяти між собою та зовнішнім середовищем, обмінюючись речовиною та енергією. Довільна термодинамічна система складається з величезної кількості частинок, що безперервно рухаються (мають кінетичну енергію) та взаємодіють між собою (мають потенційну енергію). Енергію, що залежить від внутрішнього стану фізичної системи, називають внутрішньою. Вона дорівнює сумі кінетичної та потенціальної енергій всіх частинок, з яких складається система.
За умови, що змін на атомарному та ядерному рівнях не відбувається, внутрішньоатомну та внутрішньоядерну енергію не враховують. Внутрішня енергія є функцією стану фізичної системи, при такій її зміні, коли система повертається в попередній стан,
При відсутності зовнішніх електромагнітних полів U=(V;T); U=(p;T); U=(p;V). Система рівнянь носить назву калоричних рівнянь. Для ідеального газу, в якому відсутня взаємодія між молекулами, внутрішня енергія зумовлена лише тепловим їх рухом, тобто не залежить від об’єму, а є функцією лише температури U=U(T). Якщо розглядати частинки газу як матеріальні точки, то кожна з них має набір незалежних координат, що визначають їх положення. Число незалежних координат називають кількістю ступенів вільності. Виділяють поступальні координати молекул, їх обертальні рухи та коливальні рухи атомів у кожній молекулі. На кожний поступальний та обертальний ступінь вільності припадає внутрішня енергія Таким чином, внутрішня енергія ідеальних газів залежатиме від кількості атомів в молекулі:
В ізольованій системі тіл при неминучій наявності сил тертя й опору зберігається не механічна енергія, а повна: W=WK+WП+∆U=const (у системі тіл, взаємодіючих не тільки консервативними, але й дисипативними силами, збільшується внутрішня енергія). Якщо об’єм газу збільшується, то виконується робота проти сил зовнішнього тиску. Для майже незмінного тиску ця робота дорівнює
Змінити стан системи, одже її параметри, можна двома способами: виконанням роботи та наданням (або відведенням) певної кількості теплоти. Перший принцип (закон, початок) термодинаміки Два формулювання: · Q=∆U+A (результатом одержання системою Q є збільшення її внутрішньої енергії і здійснення системою роботи проти зовнішніх сил); · ∆U=Q+A’ (приріст внутрішньої енергії системи може бути результатом як теплопередачі системі, так і здійснення над нею роботи зовнішніми силами). Застосування першого закону до ізопроцесів. 1. При Т= const не збільшується U, тобто ∆U= 0, тому Q=A або A = Q. Згідно з першим принципом не може бути тільки А > Q (неможливий "вічний двигун першого роду", який би дозволяв виконувати роботу більшу, ніж підведена ззовні енергія). У відсутності заборони А = <2 полягає недолік першого принципу. 2. При V= const: А = 0, Q =∆U. 3. При р = const вихідне рівняння першого закону незмінне. Для нескінченно малих змін перший закон термодинаміки записують у вигляді:
А – робота, виконана над газом, А’ – робота, виконана газом. Інтегруючи вираз (2), отримаємо: Q=(U2 –U1)+A12 Для циклічних колових процесів Q=A Введемо поняття теплоємності одного моля газу (молярної теплоємності), враховуючи, що U=U(T;V). Звідси:
Молярна теплоємність – фізична величина, що показує, яку кількість теплоти слід передати одному молю газу для зміни його температури на 1К. Перший закон термодинаміки приймає вигляд: dQ=CVdT + pdV У випадку ізобарного процесу pdV=RdT, отже dQ=CVdT +RdT, або
Рівняння (3) називають рівнянням Майора. З нього випливає, що при ізобарному процесі кількість теплоти, яку дістає ідеальний газ, іде не тільки на збільшення внутрішньої енергії, а й на виконання роботи в процесі розширення газу.
4. Рівняння адіабати. Адіабатний процес - процес у системі без її теплообміну з оточенням. Забезпечити умови для перебігу адіабатного процесу можна двома способами: · теплоізолювавши систему (вата, поролон, вакуум); · зменшивши час протікання процесу.
Адіабата подібна до ізотерми, але крутіша. При адіабатному стисненні більшість газів нагрівається (наприклад — нагрівання ніпеля насоса при нагнітанні повітря у камеру велосипедного колеса), а при адіабатному розширенні — охолоджується (наприклад — навіть улітку працюючий від стисненого повітря відбійний молоток вкривається інеєм). Виняток — водень і гелій: охолоджуються при стисненні, нагріваються при розширенні (зворотний ефект Джоуля-Томсона). В адіабатному процесі Q=0, отже dU+dA=0 dA=-dU Для одного моля рdV= - CVdT. З рівняння Менеделеєва – Клапейрона для одного моля
Здійснимо перетворення: Рівняння Його різновиди:
5. Політропічні процеси. Політропними називають процеси, що характеризуються довільною сталою теплоємністю С=const. Тоді
Розділимо змінні та дістанемо рівняння:
виразимо показник
Окремі випадки політропного процесу: · Ізобарний процес => С=Ср, n=0, p=const, · Ізотермічний процес => · Адіабатний процес => C=0, · Ізохорний процес => C=CV, · Теплоємність політропного процесу
6. Робота ідеального газу при різних процесах. · Ізохорний процес · Ізобарний процес · Ізотермічний процес · Адіабатний процес
Контрольні питання 1. Сформулюйте газові закони та наведіть відповідні графіки залежності параметрів газу. 2. Назвіть способи зміни внутрішньої енергії тіл. Наведіть відповідні приклади. 3. У чому особливість адіабатного процесу? Наведіть приклади.. 4. Сформулюйте перший закон термодинаміки для ізопроцесів. 5. Чому не співпадають теплоємності газу при постійному тискові та при постійному об’ємі? 6. Які процеси називають політропними? Наведіть приклади. 7. Чому дорівнює показник політропи для ізобарного, ізотермічного, ізохорного та адіабатного процессу? 8. Виведіть формули для роботи газу для різних ізопроцесів. 9. Виведіть рівняння Пуассона. 10. Виведіть рівняння Майєра.
Література 1. И.В. Савельев, Курс физики, т.І, "Наука", М., 1989, § 81-84, 86-90 2. І.М.Кучерук, І.Т.Горбачук, П.П.Луцик, Загальний курс фізики,т.І, „Техніка”, К, 2006, §16. 1 -16.5
|

 , оскільки
, оскільки 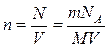 , матимемо
, матимемо . Отже, для незмінної маси газу рівняння стану ідеального газу має вигляд:
. Отже, для незмінної маси газу рівняння стану ідеального газу має вигляд:

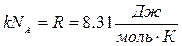 називається універсальною газовою сталою.
називається універсальною газовою сталою.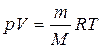 справедливе для газу масою m. І називається рівнянням Менделєєва – Клапейрона.
справедливе для газу масою m. І називається рівнянням Менделєєва – Клапейрона.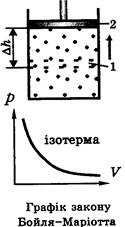 на ∆h збільшують об'єм до V2.
на ∆h збільшують об'єм до V2.
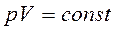 (закон Бойля-Маріотта)
(закон Бойля-Маріотта) (розширення або стиснення газу при р = const).
(розширення або стиснення газу при р = const).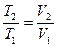
 (закон Гей-Люссака)
(закон Гей-Люссака) Ізохорний процес (грец. "chora" — простір) (нагрівання або охолодження газу в замкненому об'ємі, тобто при V- const).
Ізохорний процес (грец. "chora" — простір) (нагрівання або охолодження газу в замкненому об'ємі, тобто при V- const).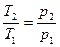
 (Закон Шарля)
(Закон Шарля)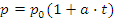
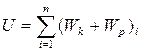
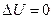 . Якщо рівноважний термодинамічний процес відбувається по довільному замкненому контуру L,
. Якщо рівноважний термодинамічний процес відбувається по довільному замкненому контуру L,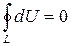
 , на коливальний ступінь -
, на коливальний ступінь -  .
.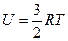



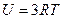

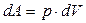
 Повна робота
Повна робота 
 Графічно робота дорівнює площі фігури, обмеженій графіком залежності p=p(V). та прямими p=0, V=V1 та V=V2. У випадку циклічних процесів робота циклу дорівнюватиме площі внутрішньої фігури.
Графічно робота дорівнює площі фігури, обмеженій графіком залежності p=p(V). та прямими p=0, V=V1 та V=V2. У випадку циклічних процесів робота циклу дорівнюватиме площі внутрішньої фігури. (1) або
(1) або (2)
(2) , оскільки
, оскільки 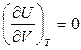 , то
, то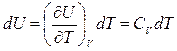 , де
, де 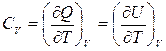 -теплоємність при сталому об’ємі.
-теплоємність при сталому об’ємі. (3)
(3) (Одягнений у кожух чи "дублянку" може надовго "потонути" у кучугурі снігу, а людина, яка вибігла з сауни неодягненою, зможе пірнути в кучугуру лише на кілька секунд без шкоди для себе).
(Одягнений у кожух чи "дублянку" може надовго "потонути" у кучугурі снігу, а людина, яка вибігла з сауни неодягненою, зможе пірнути в кучугуру лише на кілька секунд без шкоди для себе).
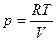 Отже
Отже  або
або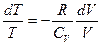 . Про інтегруємо рівняння та отримаємо:
. Про інтегруємо рівняння та отримаємо: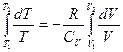
 або
або 
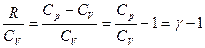
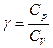
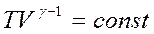 називають рівнянням Пуассона.
називають рівнянням Пуассона.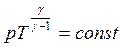

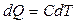
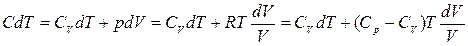
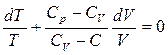 Після перетворень отримуємо:
Після перетворень отримуємо: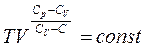 Позначимо
Позначимо 
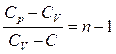 і отримаємо рівняння політропи
і отримаємо рівняння політропи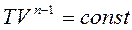
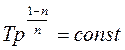
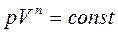
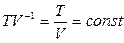
 , n=1, T=const,
, n=1, T=const, 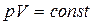
 ,
, 





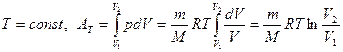
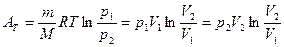
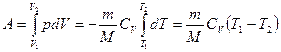 або
або 



