Приложение М
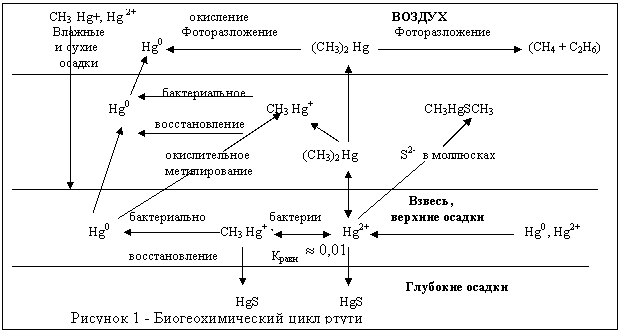
Загрязнение ртутью: причины и последствия Глобальная хозяйственная деятельность человечества приводит к существенным изменениям естественных циклов многих элементов. Такие циклы становятся природно-антропогенными и характеризуются определенными нарушениями в отлаженном миллионами лет механизме функционирования биосферы. Это в полной мере относится и к ртути. Ниже приводится статья ученого из МГУ им. М. В. Ломоносова Петросяна В. С. [61]. О ртути. В настоящее время наиболее распространенными в окружающей среде являются: металлическая ртуть Нg0, ее неорганические соединения — соли двухвалентной ртути типа HgX2 и органические производные — ртутьорганические соединения типаRHgX. Другие возможные формы, например, неорганические соли одновалентной ртути типа каломели Hg2 X2 или полные ртутьорганические соединения типа R2 Hg, безусловно, менее типичны, однако, как будет видно ниже, также могут вызывать экотоксикологические эффекты, что иногда приводит к летальному исходу. Нg0 — жидкий металл с температурой кипения 3570 С, летучий (в одном кубометре насыщенного при 250С воздуха может содержаться до 20 мг Нg), почти нерастворим в воде (максимум 0,28мкМ/л при 250С). Токсичность металлической ртути обусловлена тем, что при ее вдыхании ртутные пары легко абсорбируются в почках, мозге и других внутренних органах с последующим бионакоплением, преодолением плацентарного барьера, что приводит к острому отравлению и разрушению легких. В тканях живых организмов металлическая ртуть претерпевает процессы окисления, превращаясь в основном в соединения двухвалентной ртути. Типичным представителем солей двухвалентной ртути является сулема HgCl2 - негидролизующееся соединение с ковалентными связями. Ее температура плавления ~ 2770С, растворимость в воде 69 г/л, а в органических растворителях — весьма высокая. Сулема достаточно реакциоонноспособна по отношению к биологически активным молекулам, давая с белками соединения типа RSHgSR, приводя к агглютинации (склеивание) эритроцитов и ингибированию ферментов, чем и обусловлена известная токсичность HgCl2. Соединения этого типа легко накапливаются в почках, но, в отличие от металлической ртути, не могут эффективно преодолевать кровяной или плацентарный барьер. Острые отравления солями ртути вызывают осаждение белков из мукомембран желудочно-кишечного тракта, обусловливая боль, рвоту и расстройство желудка. Если отравившийся все же выживает, то решающий удар наносится по печени, вызывая гемолиз эритроцитов. В метилртутных солях типа CH3 HgX связь Нg-С весьма устойчива, не разрушается водой и слабо взаимодействует с кислородсодержащими основаниями и кислотами, но при замене СН3 на С6 Н 5 или CH3 OCH2 CH2 связь Hg- C разрывается достаточно легко. При взаимодействии с галогеноводородными кислотами или содержащими азот, фосфор и серу основаниями реакции протекают достаточно энергично, чем и объясняется высокая токсичность метилртутных солей по отношению к живым организмам. Метилртутные соли примерно на пять порядков (в 100 тыс. раз!) более токсичны, чем неорганические соли ртути HgX2 , и привели к эпидемиологическим нейротоксическим заболеваниям и массовым смертям в Японии в 1950 - 60 гг. и в Ираке в 1972 г. вследствие потребления населением этих стран отравленных метилртутными соединениями рыбы и зерна. Максимальной токсичностью, (на шесть порядков, т.е. в миллион раз! большей, чем метилртутные соли), обладает трудно обнаруживаемая в окружающей среде диметилртуть CH3 HgCH3 , от отравления которой погибли не только химики, впервые синтезировавшие ее в 1865г, но и некоторые из тех, кто контактировал с ней в наши дни. До осуществленной человеком научно-технической революции ртуть и ее соединения существенно не влияли на окружающую среду, так как их концентрации в природе были крайне малы (8,3х10-6 %). По мере развития цивилизации применение ртути и ее соединений становилось все более интенсивным, мировая промышленность в последнее время ежегодно производит около 9 000 т металлической ртути, а всего в двадцатом столетии было произведено примерно 500 тыс. т, из которых значительная часть в итоге оказалась в окружающей среде. Это антропогенное влияние существенно нарушило нормальный биогеохимический цикл ртути (рисунок 1), в результате чего биосфера наряду с влиянием других экотоксикантов стала испытывать и негативные эффекты ртути и ее производных.
|