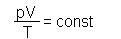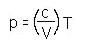Карточки индивидуальных заданий
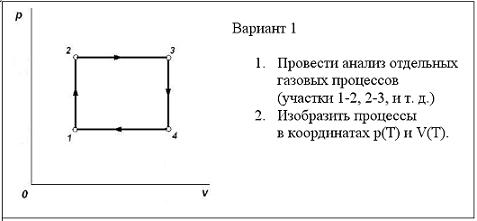
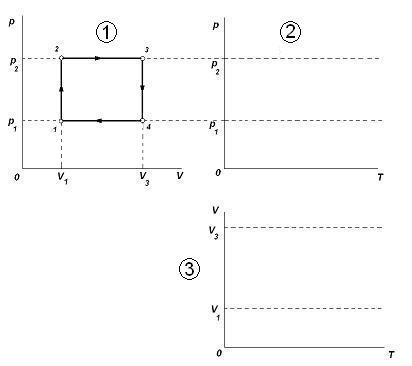
Графики изопроцессов в газах.
Умение анализировать и строить графики изменения термодинамического состояния идеального газа является показателем хорошего усвоения материала темы «Газовые законы». Если ученик формально заучил уравнение состояния идеального газа и математические выражения законов Бойля-Мариотта, Гей-Люссака и Шарля, то для него построение и анализ графиков изопроцессов будет сложной математической задачей. Но если ученик действительно понял материал, если он хорошо представляет процессы изменения состояния газа (например, без анализа уравнения «чувственно знает», что при нагревании газа в закрытом сосуде давление его повышается, а при охлаждении понижается), то читать и строить графики он будет легко.
1-2: p↑, V=const, изохорный, T↑, (Примеры рассуждений ученика: 1) давление газа растёт в закрытом сосуде. Это может происходить только за счёт нагревания газа, т.е. T↑. Или 2) Т.к. pV/T = const, и числитель растёт, то, чтобы величина дроби не менялась, знаменатель тоже должен увеличиваться, т.е. T↑) 2-3: p=const, V↑, изобарный, T↑, 3-4: p↓, V=const, изохорный, T↓, 4-1: p=const, V↓, изобарный, T↓,
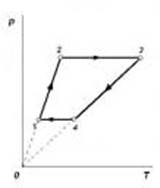
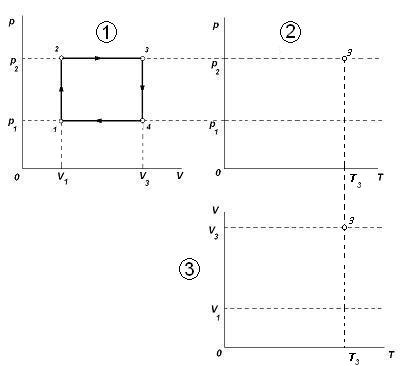
Выполнение построения начинается с произвольного изображения точки 1, соответствующей первому состоянию газа. Далее последовательно строятся отдельные участки диаграммы, руководствуясь проведённым анализом. Здесь главное, чтобы ученик не ошибся, и соотношение температур T1 < T2 < T4 < T3, видимое из первой построенной им диаграммы p(T) сохранялось и на следующей диаграмме V(T) (аналогично с объёмом газа в других заданиях). А соблюдение масштаба не так важно (важно качественное описание). В слабых классах или для слабых учеников второе задание можно опускать. В профильном же классе можно уделить внимание большей строгости в построении графиков. Тогда вычерчивание графиков выполняется следующим образом. Во-первых, располагаем удобно системы координат p,T и V,T и переносим на них данные по p и V из исходного графика:
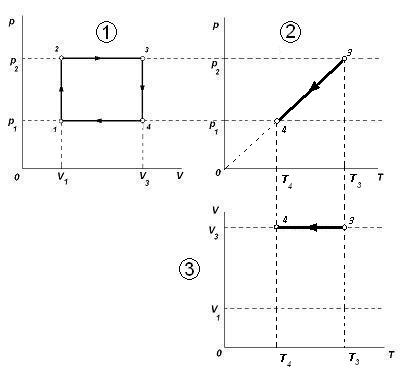
Нам не известно ни одного значения третьего параметра газа – температуры. Отметить его можно только относительно. Из первого графика видим, что максимальному значению температуры, соответствует точка 3 (через неё проходит самая верхняя изотерма – гипербола на первой диаграмме). Произвольно отмечаем максимальное значение температуры T3, которое задаст нам масштаб по оси T. Пересечение вертикальной прямой T3 с горизонтальными прямыми p2 и V3 даст точки, соответствующие состоянию газа 3 в координатах p, T и V, T.
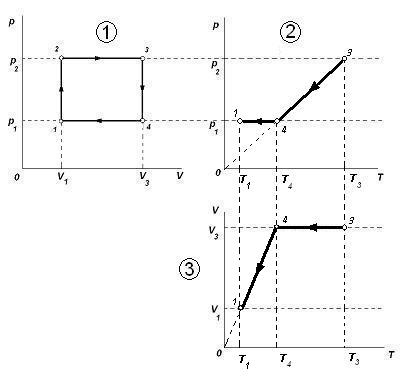
Чтобы найти точку 4, обратимся к проведённому анализу участка 3-4. Изохорному процессу 3-4 в координатах p,T соответствует прямая, проходящая через начало координат. Проводим соответствующую прямую линию, получим точку 4 и новое значение температуры T4. Пересечение линии T4 и V3 на третьем графике даст точку 4.
Далее из анализа 4-1 (прямая, проходящая через начало координат в осях V, T)находится точка 1 и соответствующая ей температура T1.
Далее анализируем процесс 4-1 и окончательно получаем:
|