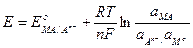Индикаторные электроды в потенциометрии
Для потенциометрических измерений используются металлические и мембранные индикаторные электроды. Металлические индикаторные электроды подразделяют на электроды первого и второго рода. Электроды первого рода представляют собой металлическую пластинку или проволоку, погруженнyю в раствор хорошо растворимой соли этого металла, например, серебряную проволоку, опущенную в раствор нитрата серебра; медную пластинку, погруженную в раствор сульфата меди. Потенциал электрода первого рода зависит от концентрации компонента, непосредственно участвующего в электродной реакции переноса электронов: Ag+ + e → Agо; Сu2+ + 2e → Cuо Металлические индикаторные электроды можно изготовить из различных металлов, способных к обратимому гетерогенному окислению, например, из серебра, меди, ртути, свинца и кадмия. Потенциалы этих металлов воспроизводимы и предсказуемо отражают активность их ионов в растворе. Такие металлы как железо, никель, вольфрам, кобальт и др. не пригoдны для изготовления индикаторных электродов, поскольку для них характерно невоспроизводимость значений потенциала, связанная с образованием оксидных слоев на поверхности электрода, с кристаллической деформацией в их структурах и т.д. Электроды второго рода состоят из металла, покрытого слоем его малорастворимого соединения (соли, оксида или гидроксида) и погруженного в раствор, содержащий тот же анион, что и в труднорастворимом соединении: Аn- | МА,МoЭлектродную реакцию и равновесный потенциал в такой системе можно записать следующим образом: МА + пе = Мo+ Аn-
С помощью электродов второго рода измеряют концентрацию ионов, не участвующих непосредственно в пpоцессе переноса электрона. Например, потенциал серебряного электрода будет правильно отражать концентрацию хлорид-ионов в растворе, насыщенном хлоридом серебра. Эти электроды широко используются и как электроды сравнения, по отношению к которым измеряют потенциалы других электродов. В мембранных (ионоселективных)электродах происходит обмен не электронов, а заряженных частиц (ионов) между раствором и мембраной электрода. Мембрана разделяет два раствора – внутренний и внешний, находящиеся в контакте с поверхностями мембраны. Через мембрану возможно перемещение ионов только определенного вида. Активность ионов, к которым мембрана проницаема, во внутреннем растворе постоянна. После погружения электрода в анализируемый раствор начинается движение иона, проникающего через мембрану, в направлении его более низкой активности. Так как ионы несут заряд, то в мембране возникает потенциал, препятствующий дальнейшему перемещению ионов. Чтобы измерить мембранный потенциал, необходимо обеспечить контакт с внутренним раствором (используют вспомогательный электрод) и с внешним раствором (применяют электрод сравнения). В настоящее время созданы электроды с жидкими и с твердыми мембранами, позволяющими определять активности многих катионов: К+; Са2+; Си2+; Cd2+; Zn2+; Рb2+; Ag+ и др.; анионов: Сl-; Вr-; J-; S2-; СO32-; S042-; NО3- и т.д.; газов: S02; H2S; С02 и т.д. Селективность мембраны определяется или избирательным поглощением определяемого иона ионообменной мембраной, или избирательным перемещением иона внутри мембраны. Широко известным примером мембранного электрода является стеклянный электрод для измерения рН растворов. Он состоит из стеклянного полого шарика (стеклянная мембрана) диаметром 15 – 20 мм с толщиной стенок 0,06 – 0,1 мм, изготовленного из стекла особого состава, например, стекла марки «корнинг» состава 22 % Na20, 6 % СаО, 72 % Si02. Внутрь шарика заливается раствор с определенным значением рН (0,01 моль/дм3 НС1) и в раствор погружается электрод сравнения (хлоридсеребряный). Мембрана отделяет внутренний раствор от анализируемого раствора, куда помещается еще один электрод сравнения:
Электрод Внешний I Стеклянная Внутренний Электрод сравнения 1 анализируемый I мембрана раствор сравнения 2 раствор [Н+] = а1 I [Н+] = а2
На внешней поверхности стекла потенциал зависит от активности ионов водорода во внешнем анализируемом растворе (а1). На внутренней поверхности стекла возникает потенциал, который остается постоянным во внутреннем растворе с постоянной активностью ионов водорода (а2) и, таким образом, потенциал стеклянного электрода становится мерой активности ионов водорода во внешнем растворе, а, следовательно, зависит от величины рН внешнего раствора. Электроды с твердыми (осадочными) мембранами применяют для определения анионов. Для этого изготавливают мембраны из солей, содержащих или определяемый ион, или катион, селективно осаждающий этот анион из водных растворов. Например, сульфат бария предложен для определения сульфат – иона, а галогениды серебра – для определения галогенид – ионов. Мембрана из соли должна обладать необходимой прочностью и проводимостью. Электроды с твердыми мембранами используют для определения Сl--; Br-; F-; J-; CN-; SCN- и других ионов. Электроды с газочувствительными мембранами. В этих электродах используется газопроницаемая мембрана. Она изготавливается чаще всего из гидрофобного водоотталкивающего пластика, и должна быть тонкой и микропористой, не пропускающей воду и электролиты. Поры мембраны заполнены воздухом или другими газами. Если раствор, содержащий газообразное определяемое вещество, например, S02, контактирует с мембраной, то S02 переходит в поры мембраны: S02 (водн) ↔ S02 (газ) внешний поры раствор мембраны
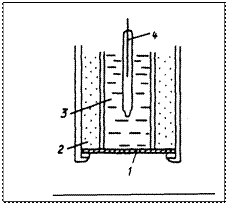
Потенциал ячейки определяется в конечном итоге только концентрацией S02 во внешнем растворе. С помощью таких электродов определяют соединения NН3; S02; (Н2SОЗ); N02; H2S; С02 (Н2СОЗ) и др. Электроды с жидкими мембранами обладают потенциалом, устанавливающимся на поверхности между анализируемым раствором и несмешивающейся с ним жидкостью мембраны, селективно реагирующей на определяемый ион. Электрод с жидкой мембраной отличается от стеклянного только тем, что раствор с известной и постоянной активностью иона отделен от анализируемого раствора тонким слоем органической жидкости, не смешивающейся с водой, а не тонкой стеклянной мембраной. Органическая жидкость представляет собой нелетучий органический ионит, содержащий кислотные, щелочные или хелатообразующие функциональные группы. Процесс обмена можно представить следующим образом: RH + M+ ↔ RM + H+ органическая водная органическая водная фаза фаза фаза фаза Электроды с жидкими мембранами позволяют проводить прямое потенциометрическое определение катионов (К+, Са2+, Mg2+ и т. д.), а также анионов (Сl-; NО3- и т.д.) На рисунке 3 показана схема ионселективного электрода с жидкой мембраной.
Рис. 3. Ионселективный электрод с жидкой мембраной [Другов Ю. С. Экологическая аналитическая химия: учебное пособие – СПб.: Анатолия, 2002. – 464 с. – Рис.IV.16, С.362] 1. мембрана; 2. ионит; 3. внутренний стандартный раствор; 4. внутренний электрод сравнения
|