Тема: «БИОСИНТЕЗ КЕТОНОВЫХ ТЕЛ, ТРИАЦИЛГЛИЦЕРОЛОВ И ФОСФОЛИПИДОВ. МЕТАБОЛИЗМ
ХОЛЕСТЕРОЛА В ОРГАНИЗМЕ» 19.1.1. Под термином «кетоновые тела» подразумевают следующие соединения: ацетоуксусная кислота (ацетоацетат), β-гидроксимасляная кислота (β-гидроксибутират), ацетон. Это – продукты неполного окисления жирных кислот. Синтез их происходит в митохондриях печени из ацетил-КоА (рисунок 19.1).
Рисунок 19.1. Реакции синтеза кетоновых тел. 19.1.2. Синтез кетоновых тел в организме усиливается при ускоренном катаболизме жирных кислот (голодание, сахарный диабет). В этих условиях в печени имеется дефицит оксалоацетата, образующегося преимущественно в реакциях углеводного обмена. Поэтому затрудняется взаимодействие ацетил-КоА с оксалоацетатом и все последующие реакции цикла трикарбоновых кислот Кребса. Ацетоуксусная и β-гидроксимасляная кислоты, которые относятся к кетоновым телам, являются сильными кислотами. Поэтому накопление их в крови приводит к сдвигу рН в кислую сторону (метаболический ацидоз). 19.1.3. Кетоновые тела как источник энергии используют миокард, лёгкие, почки, скелетные мышцы, даже головной мозг (при длительном голодании). Утилизация кетоновых тел осуществляется следующим образом (рисунок 19.2).
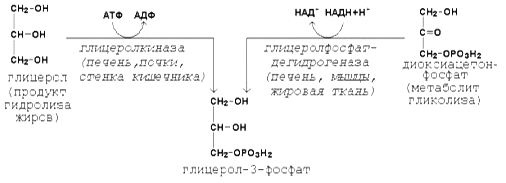
Рисунок 19.2. Реакции утилизации кетоновых тел. Образующийся ацетил-КоА окисляется в цикле Кребса. Энергетический баланс окисления ацетоацетата до конечных продуктов составляет 23 молекулы АТФ, полного окисления β-гидроксибутирата - 26 молекул АТФ. Печень не использует кетоновые тела в качестве энергетического материала. 19.2.1. Биосинтез триацилглицеролов и глицерофосфолипидов происходит в цитоплазме клеток. Первые реакции этих метаболических путей совпадают и включают образование фосфатидной кислоты. Предшественники фосфатидной кислоты - глицерол и жирные кислоты - вступают в реакцию в активной форме. Образование активной формы глицерола (глицерол-3-фосфата может происходить двумя путями (рисунок 19.3).
Рисунок 19.3. Пути образования глицерол-3-фосфата. Активация жирных кислот идёт путём образования тиоэфиров коэнзима А – ацил-КоА (см. 18.1.1, рисунок 18.1). 19.2.2. Первая реакция ацилирования глицерол-3-фосфата осуществляется за счёт КоА-производного насыщенной жирной кислоты, например, пальмитиновой. Образуется сложноэфирная связь в 1-м положении (рисунок 19.4, реакция 1). Вторая реакция ацилирования идёт, как правило, за счёт КоА-тиоэфира ненасыщенной жирной кислоты, например, олеиновой (рисунок 19.4, реакция 2). В процессе синтеза триацилглицеролов происходит дефосфорилирование фосфатидной кислоты при помощи фосфатидатфосфатазы (рисунок 19.4, реакция 3). В дальнейшем 1,2-диацилглицерол ацилируется третьей молекулой ацил-КоА, которая может содержать остаток как ненасыщенной, так и насыщенной жирной кислоты (рисунок 19.4, реакция 4).
Рисунок 19.4. Реакции биосинтеза триацилглицеролов. 19.2.3. В организме здорового человека процессы биосинтеза и катаболизма триацилглицеролов взаимно уравновешены. В тех случаях, когда углеводы, жиры или белки потребляются в количествах, превышающих энергетические потребности организма, излишки калорий запасаются в виде триацилглицеролов. Источником ацетил-КоА для биосинтеза жирных кислот могут служить как углеводы, так и углеродные цепи аминокислот. Накопленный избыток жиров может быть израсходован для получения энергии, например, при голодании. Скорость биосинтеза триацилглицеролов регулируется гормонами. Инсулин стимулирует поступление глюкозы в клетки и, следовательно, превращение её в жиры. Глюкагон и гормоны надпочечников тормозят этот процесс. 19.3.1. Как известно (9.4.2), глицерофосфолипиды являются производными фосфатидной кислоты и одного из аминоспиртов (например, этаноламина, холина или серина). Реакции образования фосфатидной кислоты обсуждались в предыдущем параграфе (см. 19.2.2, рисунок 19.4). Подобно другим предшественникам в биосинтезе липидов, аминоспирты, участвующие в синтезе фосфолипидов, вступают в реакцию в активной форме – в виде соединения с цитидиндифосфатом (ЦДФ). В качестве примера на рисунке 19.5 приводятся реакции активации этаноламина. Обратите внимание, что в реакциях активации аминоспиртов принимают участие два нуклеозидтрифосфата – АТФ и ЦТФ.
Рисунок 19.5. Реакции образования активной формы этаноламина. Далее остаток фосфоэтаноламина с ЦДФ-этаноламина переносится на 1,2-диацилглицерол, образующийся в результате дефосфорилирования фосфатидной кислоты (рисунок 19.6, реакции 1 и 2). Продуктом реакции является фосфатидилэтаноламин.
Рисунок 19.6. Реакции синтеза фосфатидилхолина. Синтез фосфатидилхолина происходит путём трёхкратного метилирования фосфатидидэтаноламина. Донором метильных групп служит S-аденозилметионин (рисунок 19.6, реакция 3). Фосфатидилхолин может образоваться также путём активации холина, подобно этаноламину. Фосфатидилсерин образуется в реакции прямого взаимодействия фосфатидилэтаноламина и серина:
19.3.2. Липотропные факторы – вещества, способствующие синтезу фосфолипидов и препятствующие отложению триацилглицеролов в тканях. Липотропный эффект этих соединений связан с тем, что общим предшественником триацилглицеролов и фосфолипидов является фосфатидная кислота. При недостатке липотропных факторов фосфатидная кислота используется преимущественно для синтеза триацилглицеролов. Они нерастворимы в воде и накапливаются в клетках, способствуя их жировому перерождению. Запомните, какие липотропные факторы можно использовать в качестве препаратов для его предупреждения: 1) холин – самое распространённое азотистое основание фосфолипидов; 2) метионин – незаменимая аминокислота, предшественник S-аденозилметионина, универсального донора метильных групп; 3) фолиевая кислота и витамин В 12 – предшественники коферментов, участвующих в реакциях переноса СН 3 -групп. При введении липотропных факторов снижается синтез триацилглицеролов и усиливается выведение жира из клеток при участии липопротеиновых комплексов (см.20.1.2). 19.4.1. Исходным соединением для синтеза холестерола является ацетил-КоА (см. 15.2.3, рисунок 15.6). Ферменты, катализирующие реакции синтеза, содержатся в цитоплазме и эндоплазматическом ретикулуме многих клеток. Наиболее активно этот процесс происходит в печени. В организме человека в сутки синтезируется около одного грамма холестерола. 19.4.2. Биосинтез холестерола включает три основные стадии (рисунок 19.7).
Рисунок 19.7. Синтез холестерола. На первой стадии образуется мевалоновая кислота (рисунок 19.7, а). На второй стадии мевалоновая кислота превращается в изопентенилпирофосфат («активный изопрен»), 6 молекул которого конденсируются в сквален (рисунок 19.7, б). На третьей стадии сквален превращается в холестерол (рисунок 19.7, в). Всего для синтеза 1 молекулы холестерола используется 18 молекул ацетил-КоА: для образования «активного изопрена» требуется 3 молекулы; в последующих реакциях конденсации участвуют 6 молекул «активного изопрена»; 3 × 6 = 18. 19.4.3. Скорость синтеза холестерола в организме регулируется по механизму отрицательной обратной связи (рисунок 19.7, пунктирная стрелка). Фермент β-гидрокси-β-метилглутарил-КоА-редуктаза катализирует лимитирующую реакцию биосинтеза холестерола. Холестерол является корепрессором синтеза данного ферментного белка, что приводит к снижению скорости катализируемой реакции. Поэтому при поступлении избытка холестерола с пищей синтез эндогенного холестерола прекращается. Холестерол является компонентом биологических мембран, из него в организме образуются стероидные гормоны, витамин D 3, желчные кислоты (см. 9.2.2). Избыток холестерола превращается в печени в желчные кислоты (см. 10.2.3, рисунок 10.3), а также выделяется с желчью в кишечник и выводится с калом. 19.4.4. Нормальное содержание холестерола в сыворотке крови человека составляет 3,9 – 6,3 ммоль/л. Транспортной формой холестерола в крови являются липопротеины (см. далее 20.1.2). Если нарушается соотношение между поступлением холестерола в организм и его выведением, то содержание холестерола в тканях и крови изменяется. Повышение концентрации холестерола в крови (гиперхолестеролемия) может приводить к развитию атеросклероза и желчно-каменной болезни.
|