Элементы главной подгруппы VII группы
В данную подгруппу входят: фтор, хлор, бром, йод и астат.
В ряду: F CI Br I At Эффективный атомный радиус увеличивается
Энергия сродства к электрону, энергия ионозации, электроотрицательность уменьшаются
Элементы VII группы в невозбужденном состоянии имеют электронную конфигурацию ns2nр5 :
Э0…ns2nр5; При возбуждении (кроме фтора) элементы подгруппы проявляют ковалентность, равную III, V и VII:
Фтор проявляет степени окисления -1 и 0, для остальных элементов подгруппы возможны степени окисления: -I, 0, +1, +3,+4, +5 и +7. Распространение в природе. Наиболее распространенные соединения фтора – флюорит CaF2 , криолит Na3[AlF6], фторапатит 3Ca(PO4)2 2CaF2. Хлор содержится в океанской воде, в виде каменной соли NaCl, сильвинита NaCl·KCl и карналлита KMgCl3·6H2O. Бром и иод самостоятельных месторождений не образуют, их добывают из буровых и подземных вод, кроме этого иод добывают из золы морских водорослей. Распространенность галогенов в природе уменьшается от фтора к иоду. Получение. В лаборатории хлор, бром и йод получают по реакциям: MnO2 + 4HCI = MnCI2 + CI2 + 2H2O; Cl2 + 2КBr = Br2 + 2КCl Cl2 + 2К J = J2 + 2КCl. Фтор в промышленности получают исключительно электролизом расплава KF·2HF (в водном растворе это невозможно, так как фтор реагирует с водой с выделением кислорода). 2F2 + 2H2O = 2HF+O2. Хлор получают электролизом растворов или расплавов солей: 2NaCl +2H2O → 2NaOH +2H2 + Cl2 2NaCl Бром и йод получают окисляя в водных растворах ионы Br- и J, хлором, напри-мер: 2NaJ + Cl2 = J20↓ + 2NaCl.
|


 Неметаллические свойства и окислительная способность уменьшаются
Неметаллические свойства и окислительная способность уменьшаются

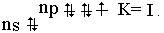

 2Na + Cl2.
2Na + Cl2.


