Химические свойства. Хлор, как и все элементы 3-го периода, отличается от своего аналога фтора, элемента 2-го периода, наличием d- подуровня
Хлор, как и все элементы 3-го периода, отличается от своего аналога фтора, элемента 2-го периода, наличием d- подуровня. Этим определяется его характер и поведение при химических реакциях. Использование d-орбиталей приводит к образованию кратных дативных связей. Именно поэтому энергия диссоциации молекулы хлора примерно в полтора раза больше, чем у фтора. У полных электронных аналогов хлора, брома и йода, также наблюдаются подобные явления, хотя и в меньшей степени, это объясняется влиянием больших радиусов атомов брома и иода. Фтор. Фтор химически очень активен, он сильнейший окислитель. Высокая химии-ческая активность фтора объясняется тем, что его молекула имеет очень низкую энергию диссоциации, тогда как химическая связь в большинстве соединений фтора отличается большой прочностью. Он легко взаимодействует со всеми ме-таллами и неметаллами, включая даже некоторые инертные газы. Фторид водорода неограниченно растворяется в воде: 2HF + H2O = H3O+ + HF2- Раствор HF (плавиковая кислота) кислота средней силы. Характерной осо-бенностью плавиковой кислоты является ее способность реагировать с SiO2, поэ-тому HF хранят в полиэтиленовой таре.: SiO2 + 4HF = SiF4↑+2H2О. HF получают действуя H2SO4 на плавиковый шпат: CaF2 + H2 SO4 = CaSO4↓ + 2HF. Хлор В соединениях хлор проявляет следующие степени окисления: -1, 0, +1, +3,+5,+7. Степени окисления хлора +2, +4 и +6 реализуются только в безразличных, легко диспропорционирующих, неустойчивых оксидах ClO, ClO2 и СlO3. Степени окисления –1 соответствует хлористый водород HСl, являющийся газообразным соединением. Это наиболее важное соединение хлора. Получить его можно при непосредственном взаимодействии хлора с водородом: H2+Cl2 = 2HCl. В чистом виде HCl – газ с резким запахом, очень легко растворяется в воде – при О0 С в 1л воды растворяется более 500 л HCl. Раствор HCl имеет кислую реакцию и называется хлороводородной кислотой(соляная кислота). Это сильная кислота реагирует, со всеми металлами, стоящими в ряду напряжения до водорода. Соли хлороводородной кислоты называются хлоридами. Положительным степеням окисления хлора соответствуют оксиды и гидроксиды:
Все оксиды и кислородные кислоты хлора неустойчивы. Оксиды обычно разлагаются со взрывом. Устойчивость кислородных кислот и их сила возрастают от HClO к HClO4 , а окислительные свойства кислот и их солей уменьшаются.
HClO HClO2 HClO3 HClO4
Оксид хлора (I) получают взаимодействием хлора с оксидом ртути (II):
Он представляет собой ядовитый желто-коричневый газ с характерным запахом. При нагревании взрывается с образованием хлора и кислорода. При растворении в воде Cl2O образует слабую (слабее угольной) хлорноватистую кислоту HClO, соли которой называются гипохлоритами. Эта кислота образуется и при взаимодействии хлора с водой в темноте. Cl2+H2O↔HClO+HCl
Cl0 + H20-1e= HClO+H+__________
HСlO − неустойчивое соединение и на свету разлагается по схеме HClO → HCl +O0.
Cl2 + 2КOH = КCl + КClO + H2O
1 Cl0+2OH- -e- = ClO -+ H2O Cl2 +2OH- = ClO - + Cl- +H2O
При пропускании хлора в горячий раствор щелочи протекает реакция: 3Сl2+6KOH = KClO3 + 5KCl + 3H2О
5 Cl0 + 1e = Cl-
3Cl2 +6OH- = ClO - + 5Cl- +3H2O
При взаимодействии хлора с гашеной известью образуется хлорная известь: Cl2 + Ca(OH)2= CaOCl2 + H2О Полученный продукт можно рассматривать как соль двух кислот – HСl и HClO:
Ca
OСl При пропускании хлора в горячие растворы щелочей образуются соли хлорноватой кислоты – хлораты: Cl2 + 6KOH= KClO3 + 5KCl + 3H2O Для получения хлорноватой кислоты раствор хлората бария обрабатывают H2SO4: Ba(ClO3)2 + H2SO4 = 2HClO3 + BaSO4↓. Таким способом удается получить растворы 40 – 50%-й концентрации HСlO3– сильная кислота, сильный окислитель, но уступающий по окислительным свойствам HClO, ее соли, хлораты, в обычных условиях устойчивы. Наиболее устойчив из всех кислотных соединений хлора оксид Cl2O7. Его получают дегидратацией хлорной кислоты: 6HClO4 + P2O5 = 3Cl2O7 + 2H 3PO4. Cl2O7 при быстром нагревании или при ударе взрывается, с водой образует хлорную кислоту, а со щелочами перхлораты: Cl2O7 + H2О = 2HClO4 Cl2O7 + 2КОН = 2KClO4 + H2O. HClO4 относится к очень сильным кислотам. Как сама кислота, так и ее соли в растворах практически не обладают окислительными свойствами. В безводных средах эти соединения могут проявлять сильные окислительные свойства, хотя они и слабее, чем у других кислородных кислот хлора.
|

 усиление кислотных свойств
усиление кислотных свойств усиление окислительной активности
усиление окислительной активности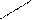 Hg-Cl
Hg-Cl 2HgO + 2Cl2 = Cl2О + О Hg-Cl.
2HgO + 2Cl2 = Cl2О + О Hg-Cl. Cl0 + 1e = Cl-
Cl0 + 1e = Cl- Cl2+H2O=HClO + H++ Cl-
Cl2+H2O=HClO + H++ Cl-
 Выделением атомарного кислорода объясняется дезинфирующее и отбеливающее действие хлорной воды. Сам хлор этими свойствами практически не обладает. Гипохлориты − более устойчивы, чем сама кислота. Образование иона ClO- облегчается в щелочной среде (реакция протекает на холоду):
Выделением атомарного кислорода объясняется дезинфирующее и отбеливающее действие хлорной воды. Сам хлор этими свойствами практически не обладает. Гипохлориты − более устойчивы, чем сама кислота. Образование иона ClO- облегчается в щелочной среде (реакция протекает на холоду): 1 Cl0 + 1e = Cl-
1 Cl0 + 1e = Cl- 1 Cl0+6OH- -5e-= ClO3-+3H2O
1 Cl0+6OH- -5e-= ClO3-+3H2O
 Cl
Cl
 Анализируя свойства кислородных соединений хлора можно сделать вывод, что в ряду ClО- - ClO2 – ClO3 – ClO4 устойчивость ионов увеличивается и, следователь-но, уменьшаются окислительные свойства. Гипохлориты являются сильными окислителями в любой среде. Хлораты в растворах окисляют только в сильно-кислой среде.
Анализируя свойства кислородных соединений хлора можно сделать вывод, что в ряду ClО- - ClO2 – ClO3 – ClO4 устойчивость ионов увеличивается и, следователь-но, уменьшаются окислительные свойства. Гипохлориты являются сильными окислителями в любой среде. Хлораты в растворах окисляют только в сильно-кислой среде.


