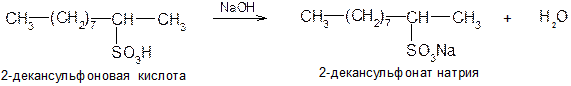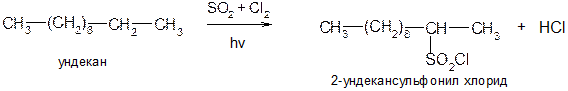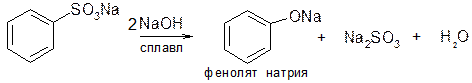Физические и химические свойства
Сульфокислоты – бесцветные кристаллические вещества. Гигроскопичны. Низшие представители легко растворимы в воде. По химическим свойствам они аналогичны серной кислоте. Наиболее сильной является трифторметансульфоновая кислота СF3SO3H. Из производных сульфоновых кислот наибольший интерес представляют соли, сульфонилхлориды, эфиры и амиды: 1) Соли сульфокислот получают обычной реакцией нейтрализации:
2) Хлорангидриды получают либо реакцией сульфохлорирования алканов, либо действием на сульфоновые кислоты PCl5:
3) Эфиры могут быть получены этерификацией сульфоновых кислот или их галогенангидридов:
4) Сульфониламиды образуются при действии на сульфонилхлориды аммиака:
Примечание: Соли высших предельных и непредельных сульфоновых кислот применяются как поверхностно-активные вещества. Сульфохлориды применяются в кожевенной и текстильной промышленности. Сульфоамиды используются в промышленности как эмульгаторы, как поверхностно-активные вещества при обработке металлов, для изготовления отбеливающих средств и т.д. Эфиры сульфоновых кислот хорошие алкилирующие средства. 5) Ароматические сульфоновые кислоты способны к реакциям замещения сульфогруппы: 5.1) Гидролиз. При действии перегретого пара в кислой среде сульфоновые кислоты дают исходные ароматические углеводороды
5.2) Реакция щелочного плава. При сплавлении солей сульфоновых кислот с едкими щелочами образуются феноляты. Это важнейший процесс получения полупродуктов в промышленности красителей:
5.3) При сплавлении солей сульфокислот с цианидами получаются нитрилы
6) Реакции бензольного кольца (см. главу ароматические углеводороды).
|