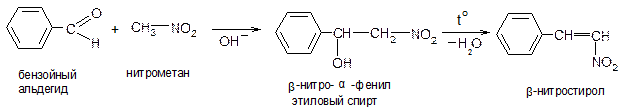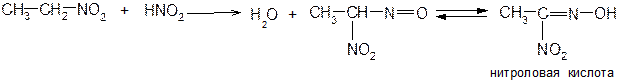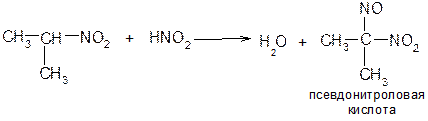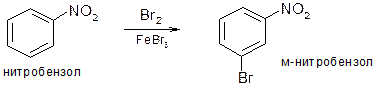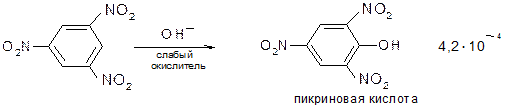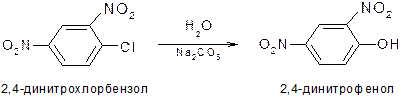Химические свойства. 1. Восстановление. Конечными продуктами восстановления нитросоединений являются первичные амины.
1. Восстановление. Конечными продуктами восстановления нитросоединений являются первичные амины.
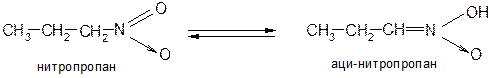
2. Действие щелочей. Таутомерия нитросоединений. Нитрогруппа, обладая сильным положительным зарядом на атоме азота, оттягивает на себя электронную плотность и увеличивает подвижность водородов у соседнего атома углерода – их способность отщепляться в виде протона. Подвижность α-водородных атомов первичных и вторичных нитросоединений проявляется в их способности реагировать со щелочами с образованием солей. Это объясняется тем, что в щелочной среде нитросоединения перегруппировываются в аци-нитроформу (кислотную):
Таким образом, нитросоединения следует рассматривать как таутомерные вещества, реагирующие в нитро- и аци-нитроформах. Если щелочные растворы нитросоединений обработать минеральной кислотой, то происходит медленный обратный сдвиг равновесия:
Поэтому нитросоединения относят к псевдокислотам. Для псевдокислот характерно, что сами они нейтральны, не обладают электропроводностью, тем не менее, образуют нейтральные соли щелочных металлов. «Нейтрализация» нитросоединений основаниями (образование нейтральных солей) идет медленно, а нейтрализация истинных кислот происходит, как известно, мгновенно. 3. Подвижность α-водородных атомов проявляется при взаимодействии первичных и вторичных нитросоединений с альдегидами:
Эта конденсация идет по альдольно-кротоновому типу. 4. Первичные и вторичные нитросоединения реагируют с азотистой кислотой, а третичные не реагируют:
Щелочные соли нитроловых кислот в растворе имеют красный цвет. Псевдонитролы в растворах и в расплавах окрашены в синий или зеленовато-синий цвет. 5. Соли аци-формы первичных и вторичных нитросоединений на холоду в водных растворах при действии минеральных кислот образуют альдегиды или кетоны (в момент выделения аци-форма подвергается гидролизу):
6. Влияние нитрогруппы в ароматическом ядре. Нитрогруппа относится к заместителям второго рода: оттягивая электроны из ароматического ядра она уменьшает его активность в реакциях электрофильного замещения. Вступающий заместитель направляется в мета-положение:
Электронная плотность особенно сильно уменьшается в орто- и пара-положениях к нитрогруппе. Обедненные электронной плотностью орто- и пара-положения ядра приобретают частичный положительный заряд, а вместе с тем и способность к необычным для ароматических соединений реакциям нуклеофильного замещения:
Оттягивая электронную плотность из ядра, нитрогруппа повышает кислотность стоящих в орто- и пара-положениях гидроксильных групп. Пикриновая кислота ведет себя, как настоящая кислота (сила ее превышает силу угольной кислоты) – образует соли, эфиры со спиртами. Под влиянием нитрогруппы увеличивается реакционная способность галогена, стоящего в орто- и пара-положениях:
|