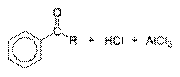Электрофильные
Хлорангидриды карбоновых кислот в присутствии кислот Льюиса (хлорид железа(III), хлорид алюминия) вступают в реакцию Фриделя-Крафтса с ароматическими соединениями, образуя ароматические кетоны. Первая стадия — отщепление атома хлора кислотой Льюиса
далее следует атака ароматического соединения карбкатионом
затем происходит отщепление водорода с образованием хлороводорода, освобождающийся хлорид алюминия образовывает комплекс с ароматическим кетоном по атому кислорода
Амиды могут быть получены при нагревании аммонийных солей карбоновых кислот:
При нагревании амидов в присутствии водоотнимающих средств они дегидратируются с образованием нитрилов:
Функциональные производные низших кислот - летучие жидкости. Все они легко гидролизуются с образованием исходной кислоты: R-CO-X + Н2О →R-CO-OH + НХ. В кислой среде эти реакции могут быть обратимы. Гидролиз в щелочной среде необратим и приводит к образованию солей карбоновых кислот, например: R-CO-OR' + NaOH → R-CO-ONa + R'OH. 4. Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала. Так, при действии галогенов на кислоты в присутствии красного фосфора образуются галогензамещенные кислоты, причем на галоген замещается атом водорода при соседнем с карбоксильной группой атоме углерода (α-атоме):
5. Окислительно-восстановительные реакции карбоновых кислот. Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды:
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота:
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа:
Муравьиная кислота — сильный восстановитель и легко окисляется до СО2. Она дает реакцию "серебряного зеркала": НСООН + 2[Ag(NH3)2]OH → 2Ag + (NH4)2CO3 + 2NH3 + H2O, или в упрощенном виде: CН3 НСООН + Аg2О → 2Аg + СО2 + Н2О. Кроме того, муравьиная кислота окисляется хлором: НСООН + Сl2 → СО2 + 2HCl. В атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О: СН3СООН + 2О2 → 2СО2 + 2Н2О. 6. Реакции декарбоксилирования. Насыщенные незамещенные монокарбоновые кислоты из-за большой прочности связи С—С при нагревании декарбоксилируются с трудом. Для этого необходимо сплавление соли щелочного металла карбоновой кислоты со щелочью:
Появление электронодонорных заместителей в углеводородном радикале способствует реакции декарбоксилирования:
|