Одноосновные предельные кислоты
Номенклатура, изомерия Названия простых карбоновых кислот часто связывают с источниками из, которых они были выделены впервые: муравьиная кислота из муравьев, уксусная кислота из уксуса и т.д. Более сложные карбоновые кислоты можно рассматривать как производные уксусной кислоты и называть по рациональной номенклатуре:
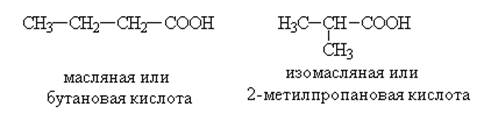
По систематической номенклатуре названия карбоновых кислот производят от названий предельных углеводородов (с тем же числом углеродных атомов) с добавлением окончания –овая и слова кислота. Главную цепь нумеруют с углерода карбоксильной группы. Изомерия карбоновых кислот зависит от строения углеродного скелета, связанного с карбоксильной группой. Например,
Способы получения Важнейшими общими способами получения карбоновых кислот являются: 1) окисление предельных (парафиновых) углеводородов воздухом или техническим кислородом при высоких температурах в присутствии, как правило, катализаторов:
2) взаимодействие олефинов с оксидом углерода (П) и водяным паром с получением:
3) окисление первичных спиртов, альдегидов, кетонов:
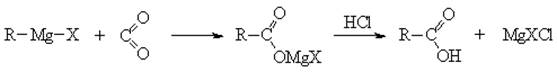
4) синтез через металлорганические соединения и СО2:
5) гидролиз (омыление) нитрилов (R–C=N):
6) омыление сложных эфиров:
Химические свойства карбоновых кислот Многие свойства карбоновых кислот обусловлены наличием в их молекулах сильно поляризованной карбоксильной группы. Так, атом кислорода, связанный с углеродом двойной связью, как более электроотрицательный, оттягивает электроны π-связи, что приводит к образованию некоторого отрицательного заряда на кислороде. Атом углерода, приобретая некоторый положительный заряд, притягивает свободную пару электронов атома кислорода из группы -ОН. Это приводит к смещению и ослаблению σ-связи кислород-водород, а также к проявлению ярко выраженного кислотного характера карбоновых кислот. В водных растворах карбоновые кислоты диссоциируют на ионы подобно минеральным кислотам с образованием ионов гидроксония:
Степень диссоциации (ионизации), а следовательно, сила карбоновых кислот обусловлены величиной и характером радикала, а также влиянием заместителей, расположенных близко к карбоксильной группе. Такие заместители, как -ОН, -Вг, -С1, -NH2, -NO2, -COOH, -СOOR (обнаруживают отрицательный индуктивный эффект –Iэф), увеличивают силу кислот, другие – углеводородные радикалы (+Iэф) – снижают степень ее диссоциации. И действительно, степень диссоциации хлоруксусной кислоты (III) примерно в 10 раз, а щавелевой (II) в 50 раз больше, чем уксусной (IV) кислоты. Трихлоруксусная кислота (I) по степени диссоциации сравнима с минеральными кислотами. Органические кислоты образуют многочисленные функциональные производные по σ-связям карбоксильной группы, а именно:
2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот: 2RCOOH + Мg → (RCOO)2Mg + Н2, 2RCOOH + СаО → (RCOO)2Ca + Н2О, RCOOH + NaOH → RCOONa + Н2О, RCOOH + NaHCO3→ RCOONa + Н2О + СО2↑. Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей: CH3COONa + HCl → СН3СООН + NaCl. Соли карбоновых кислот в водных растворах гидролизованы: СН3СООК + Н2О Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных. 3. Образование функциональных производных карбоновых кислот. При замещении группы ОН в карбоновых кислотах различными группами (X) образуются функциональные производные кислот, имеющие общую формулу R—СО—X; здесь R означает алкильную группу. Хотя нитрилы имеют другую общую формулу (R—CN), обычно их также рассматривают как производные карбоновых кислот, поскольку они могут быть получены из этих кислот. Хлорангидриды получают действием хлорида фосфора (V) на кислоты: R-CO-OH + РСl 5 → R-CO-Cl + РОСl3 + HCl.
Ангидриды образуются из карбоновых кислот при действии водоотнимающих средств: 2R-CO-OH + Р2О5 → (R-CO-)2O + 2НРО3. Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
Механизм реакции этерификации был установлен методом "меченых атомов". Сложные эфиры можно также получить при взаимодействии хлорангидридов кислот и алкоголятов щелочных металлов: R-CO-Cl + Na-O-R' → R-CO-OR' + NaCl.
|





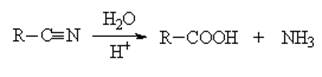

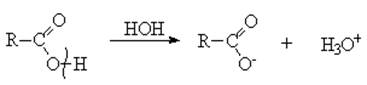


 СН3СООН + КОН.
СН3СООН + КОН. Этановая(уксусная) Бензойная кислота
хлорангидрид кислоты
Этановая(уксусная) Бензойная кислота
хлорангидрид кислоты
 Этаноилхлорид Бензоилхлорид (ацетилхлорид)
ангидрид кислоты
Этаноилхлорид Бензоилхлорид (ацетилхлорид)
ангидрид кислоты
 Этановый(уксусный) бензойный ангидрид
ангидрид
сложый эфир
Этановый(уксусный) бензойный ангидрид
ангидрид
сложый эфир
 Этилэтаноат(этилацетат) Метилбензоат
амид
Этилэтаноат(этилацетат) Метилбензоат
амид
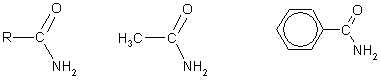 Этанамид(ацетамид) Бензамид
Нитрил
Этанамид(ацетамид) Бензамид
Нитрил
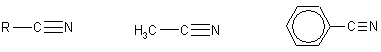 Этаннитрил Бензонитрил
(ацетонитрил)
Этаннитрил Бензонитрил
(ацетонитрил)




