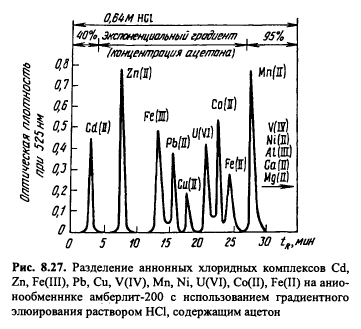
Ионообменная, иоиная, ион-парная хроматографии
В основе методов ионообменной, ионной и ион-парной хроматографии лежит динамический процесс замещения ионов, связанных с неподвижной фазой, ионами элюента, поступающими в колонку. Основная цель хроматографического процесса — разделение органических или неорганических ионов с зарядом одного и того же знака. Удерживание в этих видах хроматографии определяется изменением свободной энергии реакции ионного обме- на. Соотношение концентраций обменивающихся ионов в растворе и в фазе сорбента определяется ионообменным равновесием. Некоторые физико-химические свойства ионообменников. Ионный обмен заключается в том, что некоторые вещества (ионообменники) при погружении в раствор электролита поглощают из него катионы или анионы, выделяя в раствор эквивалентное число других ионов с зарядом того же знака. Между катионообменником и раствором происходит обмен катионов, между анионообменником и раствором — обмен анионов. Катионообменни- ки часто представляют собой специально синтезированные полимерные нерастворимые в воде вещества, содержащие в своей структуре ионогенные группы кислотного характера: -S03H; -СООН, -ОН, -Р03Н2; -As03H2. Химические формулы катионообменников схематически можно изобразить следующим образом: RS03H; RS03Na или просто R-H, R-Na. В первом случае катионообменник находится в Н-форме, во втором — в Na-форме; R — полимерная матрица. Катионообменные реакции записывают как обычные химические гетерогенные реакции. Анионообменники содержат в своей структуре ионогенные группы основного характера: -N(CH3)3; =NH2; =NH+ и др. Их химические формулы могут быть изображены как RNH3OH и RNH3C1 (или R-OH, R-C1). В первом случае анионообменник находится в ОН-форме, во втором — в Cl- форме. Известны амфотерные ионообменники, содержащие в своей структуре и кислотные и основные группы. Ионообменники, содержащие однотипные (например, -S03) кислотные (основные) группы, называют монофункциональными; ионообменники, содержащие разнотипные (например, -S03Hh -ОН) кислотные (основные) группы, — полифункциональными. Характер ионогенных групп легко определить потенциометрическим титрованием (ка- тионообменники титруют щелочью, анионообменники — кислотой). Кривые титрования ионообменников аналогичны кривым титрования растворимых сильных кислот, слабых кислот и их смесей. Синтетические ионообменники получают реакциями поликонденсации либо полимеризации. Методом поликонденсации чаще получают полифунк- циональные ионообменники, методом полимеризации — монофункциональные. Поликонденсацию или полимеризацию необходимо провести так, чтобы полученные линейные цепи были достаточно разветвлены и связаны друг с другом «мостиками». При получении катионообменников полимеризацион- ного типа часто в качестве сшивающего агента для создания межцепных (поперечных) связей применяют дивинилбензол (ДВБ). Пористость (сетчатость) ионообменника определяется степенью сшивания матрицы, которая характеризуется процентным содержанием ДВБ в полимерной смеси стиролов, используемых для синтеза. Процесс сшивания управляем, поэтому можно получать ионообменники нужной пористости. Процент ДВБ обычно составляет от 1 до 16. Наиболее часто используемые ионообменники содержат 4 —9% ДВБ. Селективность ионного обмена. Ионообменники, содержащие в своей структуре сильнокислотные или сильноосновные группы, вступают в реакции обмена с любыми ионами раствора, обладающими зарядом того же знака, что и знак противоиона. Такие ионообменники называют универсальными. Экспериментально установлены ряды сродства, или селективности, ионов по отношению к ионообменникам. Так, при низких концентрациях раствора на сильнокислотных катионообменниках ионы с одинаковым зарядом сорбируются в такой последовательности: Li+ < Na+ < К+ < Rb+ < Cs+ Mg2+ < Ca2+ < Sr2+ < Ba2+ Для ионов с разными по величине зарядами сорбируемость увеличивается с увеличением заряда: Na+ < Са2+ < А13+ < Th4+ Для решения практических задачварьируют условия разделения элементов подбором подходящей подвижной фазы (концентрация, pH, ионная сила, состав). Способы достижения селективности различны (например, присутствие органического растворителя в подвижной фазе); влияя на устойчивость и состав комплексов разделяемых компонентов, можно выделить многие элементы:
Повышения селективности ионообменников можно добиться и другими путями. Так, изменяя пористость сорбента, т. е. число поперечных связей в матрице, можно создать ионитовые сита, проницаемые для одних ионов и способные к их обмену и непроницаемые для других. Можно также изменить природу и взаимное расположение ионогенных групп, а также получить сорбенты, способные к селективным химическим реакциям за счет комплексообразовання в фазе ионообменников. Неподвижные фазы. В ионообменной, ионной и ион-парной хроматографии в качестве неподвижных фаз используют неорганические и органические ионообменные материалы. Наибольшее значение имеют синтетические макро- и микросетчатые органические ионообменники. Эти ионообменники имеют большую обменную емкость (3—7 ммоль/г), их используют в классической ионообменной хроматографии, а также в ионной хроматографии в компенсационных колонках. Микросетчатые ионообменники способны к обмену ионов только в набухшем состоянии, макросетчатые — в набухшем и ненабухшем состояниях. Другим структурным типом ионообменников являются поверхностно-пленочные ионообменники, твердая сердцевина которых изготовлена из сополимеров стирола и дивинилбензола, стекла или силикагеля и окружена тонкой пленкой ионообменника. Толщина пленки порядка 1 мкм, общий диаметр частицы 40 мкм. Недостатком таких сорбентов является достаточно большой диаметр их частиц и малая емкость из-за низкой удельной поверхности, что вынуждает работать с малыми пробами и высокочувствительными детекторами. Эти сорбенты достаточно быстро отравляются, их не регенерируют. Большое распространение в ВЭЖХ получили объемно-пористые сорбенты с диаметром частиц 5—10 мкм. Поэтому в ионной хроматографии применяют объемно-пористые полистирольные ионообменники с dp ~ 10 мкм,объемно-пористые кремнеземы с dp ~ 5—10 мкм, поверхностно-пористые ионообменники, практически не набухающие, емкостью 0,02—0,05 ммоль/г, а также поверхностно-модифицированные ненабухающие сополимеры стирола и дивинилбензола с ионогенными сульфо- или аминогруппами емкостью 0,01—0,2 ммоль/г и диаметром частиц 40—60 мкм. Например, зерно латексного анионообменника состоит из трех слоев. Ядро представляет собой инертный сополимер стирола и ДВБ, затем следует катионообменный слой сольватированных сульфогрупп; последний слой (ионогенный) — ами- нированный латекс толщиной 0,1—0,5 мкм. В ион-парной хроматографии используют «щеточные» сорбенты — силикагели с привитыми обращенными фазами С2, С8, С18. Эта фаза легко превращается в катионо- или анионообменник при поглощении из подвижной фазы ионогенных поверхностно-активных веществ, например алкилсульфатов или солей четвертичных аммониевых оснований. Подвижные фазы. Хроматографические разделения с использованием ионообменников чаще всего проводят в водных растворах, так как вода обладает прекрасными растворяющими и ионизирующими свойствами. Под действием воды молекулы пробы мгновенно диссоциируют на ионы, ионогенные группы ионообменников гидратируются и также переходят в полностью или частично диссоциированную форму. Это обеспечивает быстрый обмен противоионов. На элюирующую силу подвижной фазы основное влияние оказывают pH, ионная сила, природа буферного раствора, содержание органического растворителя или поверхностно-активного вещества (ион- парная хроматография). Кинетика ионного обмена. При ионном обмене происходит перенос противоионов в фазе ионообменника и в растворе к границе раздела фаз и от нее. Переносу ионов в растворе к поверхности раздела фаз способствует перемешивание. Однако даже при самом эффективном перемешивании раствора зерно ионообменника окружено неподвижной жидкой пленкой раствора толщиной примерно 10 3—10 2 см. Процесс ионного обмена между зернами ионообменника и хорошо перемешиваемым раствором сводится к трем последовательным стадиям: диффузия обменивающихся противоионов через стационарную пленку, окружающую зерно ионообменника (пленка Нернста); диффузия их в зерне ионообменника; химический обмен. Последняя стадия протекает практически мгновенно, поэтому ионный обмен рассматривают как чисто диффузионный процесс, скорость которого определяется самой медленной стадией; либо диффузией в пленке (пленочная кинетика), либо диффузией в зерне (гелевая кинетика). Диффузия в пленке может быть скоростьопределяющей стадией в системе с высокой концентрацией фиксированных ионов, малой степенью поперечной связанности ионообменника, небольшим размером зерен, низкой концентрацией раствора (< 0,01 М). При обмене в концентрированных растворах (> 0,01 М) лимитирующая стадия, как правило, — диффузия в геле. При средних скоростях потока подвижной фазы в колонке и больших значениях коэффициента распределения лимитирующей стадией является диффузия в пленке. При увеличении скорости потока подвижной фазы уменьшается толщина пленки Нернста, скорость массообмена растет. Скорость обмена в большинстве хроматографических колонок определяется диффузией в зерне. При использовании поверхностно-пленочных сорбентов с толщиной ионогенного слоя 1—3 мкм или поверхностно-модифицированных латексных анионообменников с толщиной ионогенного слоя 0,1—0,5 мкм достигается высокая скорость массопереноса. Связано это с тем, что путь диффузии обменивающихся ионов чрезвычайно короткий, вклад продольной и вихревой диффузии в размывание хроматографической полосы уменьшается, что и обеспечивает получение высокоэффективных колонок.
Ионная хроматография. Это экспрессный метод определения органических и неорганических ионогенных соединений, сочетающий ионообменное разделение с высокочувствительным кондуктометрическим детектированием. Последнее возможно только при низкой фоновой электропроводности. Используют двух- и одноколоночный варианты. В основу классического варианта метода положено: элюентное ионообменное разделение катионов или анионов в разделяющей колонке, заполненной ионообменником низкой емкости; подавление фонового сигнала элюента в подавляющей (компенсационной) колонке, заполненной ионообменником с высокой емкостью; кондуктометрическое детектирование ионов после разделения (двухколоночный вариант). В результате элюент преобразуется в воду, а разделяемые ноны М+ кондуктометрически детектируются в виде гидроксидов (сильные электролиты). При разделении анионов с использованием в качестве элюента 0,001 М NaOH в разделяющей колонке, заполненной анионообменником, происходит анионный обмен и разделение анионов. При использовании элюентов с низкой электрической проводимостью кондуктометрический детектор присоединяют непосредственно к разделяющей колонке. Такой вариант ионной хроматографии назван одноколоночным. В качестве элюентов применяют ароматические кислоты или их соли, pH элюентов изменяется от 3 до 8. Используют и другие детекторы, например спектрофотометрический, люминесцентный, полярографический — в этом одно из преимуществ одноколоночного варианта. Однако пределы обнаружения ионов в одноколоночном варианте ионной хроматографии обычно выше, чем в двухколоночном, а линейность градуировочного графика находится в более узком интервале. Примеры эффективных разделений методом ионной хроматографии приведены на рис. 8.28 и 8.29. Ион-парная хроматография. Этот метод расширяет возможности использования ВЭЖХ и сорбентов на основе силикагеля с привитыми алкильными группами C8 — C18 и позволяет определять ионизированные вещества. Последние обычно слабо удерживаются на неполярной поверхности силикагеля, содержащей связанные алкильные группы, из-за высокой растворимости в полярной подвижной фазе (например, в воде), быстро элюируются и поэтому плохо разделяются. Для увеличения взаимодействия ионогенных соединений с неполярной неподвижной фазой ее динамически модифицируют, т. е. в элюент вводят небольшое количество (10~2—10“3 М) вещества, называемого ион-парным реагентом, обычно имеющим достаточно большую органическую часть и хорошо адсорбирующимся алкилированным силикагелем. Адсорбированный реагент модифицирует поверхность сорбента таким образом, что она становится аналогичной поверхности обычного ионооб- менника. В качестве ион-парного реагента часто используют алкиламины, алкилсуль- фонаты, алкилсульфаты и другие ионогенные поверхностно-активные вещества. Возможны два механизма удерживания и разделения ионных соединений методом ион-парной хроматографии. < Ион-парный реагент сорбируется на обращенной фазе за счет неспецнфических взаимодействий, например с октадецилсиланом. В зависимости от природы ион- парного реагента полученный при этом сорбент можно рассматривать как катионо- или аннонообменник. Так, для разделения Ag, Си, Ni, Со, Аи и Fe(III) в виде анионных комплексов с цианидом в качестве ион-парного реагента в подвижную фазу (метанол) вводят водный 2,5-10~3 М раствор гидросульфата тетрабутиламмония (65:35). Обращенная фаза превращается в аннонообменник, на котором за 30 мин может быть выполнен анализ смеси рассматриваемых анионов. Если поверхность неполярного сорбента модифицировать перхлорат-, хлорид- и бромид-ионами, алкилсульфонатом или алкилсульфатом, то сорбент будет выступать в роли катионообменника. Ион-парный реагент образует с разделяемыми соединениями ионную пару в растворе, которая в соответствии со своими свойствами сорбируется на обращенной фазе кремнийорганическим сорбентом. Примером является разделение ароматических кислот (HR). В подвижную фазу вводят хлорид тетрабутиламмоиия (ТБА), что приводит к образованию ионных пар в подвижной фазе ТБА+ +HR-» [R~TBA+]+H+. Эти пары лучше удерживаются поверхностью силикагеля и более селективно за счет неспецифических взаимодействий с привитыми алкильными цепями
|