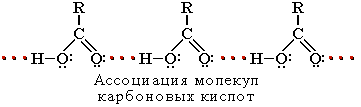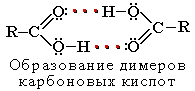Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга. Это влияние передается по системе сопряжения sp 2-атомов O–C–O.
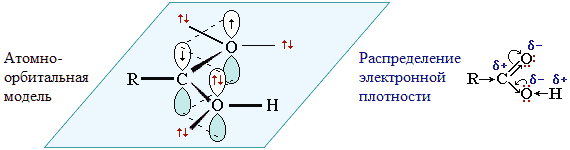
Электронное строение группы –СООН придает карбоновым кислотам характерные химические и физические свойства.
- Смещение электронной плотности к карбонильному атому кислорода вызывает дополнительную (по сравнению со спиртами и фенолами) поляризацию связи О–Н, что определяет подвижность водородного атома (кислотные свойства).
В водном растворе карбоновые кислоты диссоциируют на ионы:

Однако карбоновые кислоты в целом – слабые кислоты: в водных растворах их соли сильно гидролизованы.
 Видеоопыт "Карбоновые кислоты – слабые электролиты".
Видеоопыт "Карбоновые кислоты – слабые электролиты".
- Пониженная электронная плотность (δ+) на атоме углерода в карбоксильной группе обусловливает возможность реакций нуклеофильного замещения группы -ОН.
- Группа -СООН за счет положительного заряда на атоме углерода снижает электронную плотность на связанном с ней углеводородном радикале, т.е. является по отношению к нему электроноакцепторным заместителем. В случае предельных кислот карбоксильная группа проявляет -I -эффект, а в непредельных (например, CH2=CH-COOH) и ароматических (С6Н5-СООН) – -I и -М -эффекты.
- Карбоксильная группа, являясь электроноакцептором, вызывает дополнительную поляризацию связи С–Н в соседнем (α-) положении и увеличивает подвижность α-водородного атома в реакциях замещения по углеводородному радикалу.
См. также "Реакционные центры в молекулах карбоновых кислот".
Атомы водорода и кислорода в карбоксильной группе -СООН способны к образованию межмолекулярных водородных связей, что во многом определяет физические свойства карбоновых кислот.
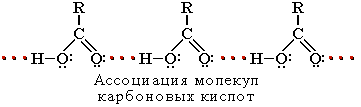
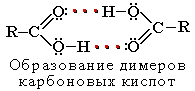
Вследствие ассоциации молекул карбоновые кислоты имеют высокие температуры кипения и плавления. При нормальных условиях они существуют в жидком или твёрдом состоянии.
Например, простейший представитель – муравьиная кислота НСООН – бесцветная жидкость с т. кип. 101 °С, а чистая безводная уксусная кислота CH3COOH при охлаждении до 16,8 °С превращается в прозрачные кристаллы, напоминающие лед (отсюда ее название ледяная кислота).
 Видеоопыт "Ледяная уксусная кислота".
Видеоопыт "Ледяная уксусная кислота".
Простейшая ароматическая кислота - бензойная C6H5COOH (т. пл. 122,4°С) - легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей.
 Видеоопыт "Возгонка бензойной кислоты".
Видеоопыт "Возгонка бензойной кислоты".
Растворимость карбоновых кислот в воде обусловлена образованием межмолекулярных водородных связей с растворителем:

Низшие гомологи С1-С3 смешиваются с водой в любых соотношениях. С увеличением углеводородного радикала растворимость кислот в воде уменьшается. Высшие кислоты, например, пальмитиновая C15H31COOH и стеариновая C17H35COOH – бесцветные твердые вещества, не растворимые в воде.



 Видеоопыт "Карбоновые кислоты – слабые электролиты".
Видеоопыт "Карбоновые кислоты – слабые электролиты".