Порядок виконання роботи. до виконання розрахунково-практичних робіт з дисципліни «Біотрансформація промислових відходів» для студентів спеціальності
Навчальне видання Методичні вказівки до виконання розрахунково-практичних робіт з дисципліни «Біотрансформація промислових відходів» для студентів спеціальності 7.05140101, 8. 05140101 “Промислова біотехнологія” денної і заочної форм навчання
Укладачі: ГАРМАШ Світлана Миколаївна ГЕЙСУН Анастасія Анатоліївна КУШНІР Ірина Петрівна
Редактор Л.М. Тонкошкур Коректор В.П. Синицька
Підписано до друку. Формат 60х80 1/16. Папір ксерокс. Друк різограф. Ум.-друк. арк.. Обл.-вид. арк.. Тираж 100 прим. Зам. №. Свідоцтво ДК № 303 від 27.12.2000 ДВНЗ УДХТУ, 49005, Дніпропетровськ-5, просп. Гагаріна,8 Видавничо-поліграфічний комплекс ІнКомЦентру ЗМІСТ Вступ ……………………………………………………………………………… 4
Загальні правила техніки безпеки при роботі у мікробіологічній лабораторії ………………………………………………………………………… 5
Лабораторна робота № 1. Біотрансформація органічних відходів відходів методом вермикультивування………..…………………………………………… 6
Лабораторна робота № 2. Отримання водних витяжок рослинних відходів переробної промисловості та визначення їх кислотності………………….……. 8
Лабораторна робота № 3. Визначення щільності пентозановмісної рослинної сировини..…………………………………………………………..………………. 10
Лабораторна робота № 4. Метод біологічної трансформації забруднень стічних вод ………………………………………………………………………….. 14
Лабораторна робота № 5. Анаеробна трансформація органічних відходів в біогаз………………………………………………………………………………… 19
Расчетно-практическая работа № 6. Гидролиз целлюлозосодержащего сырья ….25
Список літератури…………………………………………………………………... 30
ВСТУП Методичні вказівки призначені до лабораторних занять з курсу “Біотрансформація промислових відходів ” для студентів V курсу денної та VІ курсу заочної форм навчання за спеціальністю “Промислова біотехнологія”. Предметом навчальної дисципліни “Біотрансформація промислових відходів” є теоретичні і практичні основи вивчення процесів біотрансформації відходів промислових, харчових, переробних та агропромислових підприємств з метою їх біоутилізації та одержання екологічно безпечних біодобрив, кормових добавок та ін. біопродуктів. Вивченню дисципліни “Біотрансформація промислових відходів” передує комплекс технічних і природничих наук (вища математика, неорганічна хімія, органічна хімія, фізика, фізична та колоїдна хімія, біохімія, загальна біологія, промислова мікробіологія, екологія, процеси і апарати біотехнологічних виробництв, промислова біоенергетика, основи проектування біотехнологічних виробництв, екологічна біотехнологія), які є фундаментом для її засвоєння. Біотрансформація взагалі відображує специфічне її використання для вирішення проблем біоутилізації відходів, що виникають на підприємствах харчової, фармацевтичної, переробної промисловості, а також агропромислового комплексу. Курс “Біотрансформація промислових відходів” орієнтує на застосування спрямованих екологічно безпечних біотехнологічних процесів у практичній діяльності. Метою вивчення дисципліни “Біотрансформація промислових відходів” є теоретична підготовка студентів – майбутніх фахівців для вміння, використовуючи біотехнологічні методи, визначати шляхи можливої реалізації екологічно безпечних процесів біотрансформації і практичного втілення їх у різних галузях народного господарства. Завданням дисципліни “Біотрансформація” є ознайомлення з поняттями та термінами, різними видами біосировини, біопрепаратів підприємств, застосуванням процесів біотрансформації у різних галузях промисловості та сільського господарства. Основна мета методичних вказівок: – закріплення теоретичних знань, що отримані студентами на лекціях за курсом “Біотрансформація”; – використовування базових знань при проведенні досліджень по біотрансформації промислових, харчових відходів, а також відходів агропромислового комплексу з метою застосовування їх у народному господарстві; – аналіз екологічної безпеки біохімічних перетворень при отриманні продуктів біотрансформації; – визначення якості кінцевих продуктів біотрансформації; – знаходження відповідного застосування продуктам біотрансформації в промисловості й сільському господарстві.
Загальні правила техніки безпеки при роботі у мікробіологічній лабораторії
1. Лабораторія повинна утримуватися в ідеальній чистоті. 2. У лабораторію забороняється входити у верхньому одязі і класти на робочі столи сторонні предмети (сумки, портфелі й інші особисті речі). 3. У мікробіологічній лабораторії дозволяється працювати тільки в халатах, що захищають одяг від забруднення мікроорганізмами, а також перешкоджають поширенню їх за межі лабораторії. 4. За кожним студентом закріплюється постійне робоче місце і мікроскоп. Робоче місце під час занять утримується в повному порядку, на ньому не повинно бути нічого зайвого. 5. Необхідно чітко виконувати інструкції до лабораторних занять. Роботу з біологічним матеріалом проводити тільки інструментами. 6. Робоче місце, де безпосереднє проводиться робота з культурами мікроорганізмів, вимагає особливо ретельної обробки. Стіл перед початком роботи варто дезінфікувати. 7. Під час виконання практичних занять зберігати тишу, запобігати зайвого ходіння, відкривання та закривання дверей, що посилює рух повітря. 8. Дуже важливо навчитись економно витрачати реактиви та фарби, бережливо відноситися до лабораторного обладнання й апаратури, особливо до мікроскопа, дотримуватись правил особистої гігієни та профілактики. 9. Закінчивши роботу із заразним матеріалом, необхідно провести профілактичну дезінфекцію рук і робочого місця. Для дезінфекції відпрацьованого матеріалу після занять вживають 2%-ий розчин хлораміну чи 3%-ний розчин карболової кислоти. Для знезаражування рук після роботи, як правило, використовують ізопропіловий або етиловий спирт, розчин хлораміну в концентрації 0,5%, потім руки миються з милом. 10. На всіх пробірках і чашках обов'язково пишеться назва мікроорганізмів, дата його посіву, прізвище студента, № групи. 11. Не можна виносити за межи кафедри будь-які матеріали (пробірки, фарби та ін.). 12. Про випадки улучення досліджуваного матеріалу культури мікроорганізмів на руки, стіл, халат чи взуття необхідно негайно повідомити викладача і під його керівництвом провести дезінфекцію. 13. У лабораторії категорично забороняється приймати їжу, пити воду, курити. Не допускаються зайві ходіння, різкі рухи, сторонні розмови (особливо під час посіву мікроорганізмів). 14. Металеві предмети (бактеріологічні петлі, голки й пінцети) після кожного зіткнення з культурами пропалюють у полум'ї спиртівки. Використані шпателі, предметні та покривні стекла, піпетки поміщають у банки з дезінфікуючим розчином. Класти на стіл названі предмети категорично забороняється. 15. Забруднені патологічним матеріалом чи культурою мікробів градуйовані та пастерівські піпетки, скляні шпателі й металеві інструменти негайно після використання опускають у ємності з дезінфікуючим розчином.
Лабораторна робота № 1
БІОТРАНСФОРМАЦІЯ ОРГАНІЧНИХ ВІДХОДІВ ВІДХОДІВ МЕТОДОМ ВЕРМИКУЛЬТИВУВАННЯ
1.1 Загальні відомості
Вермикомпостування - це екологічно безпечний спосіб утилізації органічних відходів різного походження за допомогою співтовариства дощових черв'яків (люмбрициди). Вермикомпости є високоцінними органічними добривами, при внесенні в грунт вони стимулюють процеси природного відновлення родючості. Вермикомпостування відходів тваринництва одночасно вирішує три важливі проблеми сучасної цивілізації: отримання цінних добрив, утилізації відходів тваринництва і охорони природного середовища в зонах великих тваринницьких комплексів. Органічні відходи, проходячи через кішківник люмбрицидів, перетравлюються під дією ензимів і кишкової мікрофлори, розкладаються до простіших сполук, структуруються, збагачуються гуміновими кислотами, кальцієм, магнієм, фосфорною кислотою. Багато мінеральних сполук переходять в доступні для рослин форми. Дощові черв'яки виконують оздоровчі і знезаражувальні функції, утилізують патогенну грунтову мікрофлору, поглинають і переварюють бактерії, водорості, гриби і їх спори, простіших і нематод. Сімейство люмбріцидів включає понад 200 видів дощових черв'яків, які відносяться до різних морфо-екологічних груп. Найбільш поширеними є два види: компостні черв'яки (Eisenia fоetida) і грунтові черв'яки (Lumbricus terrestris). Каліфорнійські черв'яки (E.f. аndrei) - промислова лінія, що створена Барретом, не адаптовані до кліматичних умов України, гинуть в природному середовищі в зимовий період. У вермикомпостах усіх видів люмбрицидів відмічено збільшення чисельності целюлозолітичної мікрофлори, грибів, актиноміцетів, мікроорганізмів, що беруть участь в трансформації органічних форм фосфору, нітрифікуючої мікрофлори і мікрофлори, що здійснює азотфіксацію. Грунтові люмбрициди (L. terrestris) у біогеоцінозах підвищують трансформацію лігно-целюлозного комплексу і азотфіксацію. Мета роботи:
Вивчити процес біотрансформації рослинних відходів методом вермикультивування.
Матеріали: вермикультура Eisenia foetida, подрібнене соняшникове, гречане лушпиння, відпрацьований активний мул. 1.2 Порядок виконання роботи: Зважити по 100 г подрібнених рослинних відходів. Приготувати субстрат для вермикультивування: додати до наважки по 150-200 мл води і перемішати. Для кожного досліду відібрати по 5 шт. вермікультури Eisenia foetida і зважити на технічних вагах з точністю до 0,01 г. Помістити вермікультуру в зволожені субстрати. Спостереження за змінами біомаси вермікультури і субстратів в процесі їх біотрансформації проводяться протягом 2 місяців. Зважування вермікультури проводити 1 раз в 2 тижні. Результати дослідів внести в таблицю 1.1. Таблиця 1.1 – Зміна біомаси вермікультури в процесі біотрансформації рослинних відходів
Біомаса субстратів визначається на початку та вкінці досліду.
Таблиця 1.2 – Зміна маси субстрату в процесі біотрансформації рослинних відходів
Зробити висновки про зміну біомаси вермікультури і зміни структури субстратів і їх ваги в процесі біотрансформації.
ОТРИМАННЯ водних витяжок РОСЛИННИХ ВІДХОДІВ 2.1 Загальні відомості
До біологічних методів трансформації рослинних відходів відносяться процеси ферментативного гідролізу і ферментації. В основі гідролізу полісахаридів рослинної сировини лежить реакція кислотно-каталітичного розщеплення глікозидних зв'язків з приєднанням води. Прикладом реакції гідролізу полісахаридів є реакція гідролізу дисахаридів, наприклад, целлобіоза:
С12Н22О11 + Н2О = 2 С6Н12О6 целлобіоза глюкоза
Дана реакція мономолекулярна. Вона проходить при нагріванні в присутності іонів водню, які є каталізатором реакції гідролізу полісахаридів. Константа швидкості гідролізу деревини розведеними кислотами прямо пропорційно залежить від чотирьох констант:
К = б · Н · д · л
де б – відносна каталітична активність каталізатора; Н – концентрація каталізатора, виражена числом його г-екв в 1 дм3 розчину; д – відносний коефіцієнт стійкості полісахаридів до гідролізу; л – відносний коефіцієнт, що характеризує вплив температури реакції
Каталізатором реакції гідролізу полісахаридів є іони водню, які утворюються у водних розчинах при дисоціації кислот або солей. Чим більше концентрація джерела іонів водню, тим вище константа швидкості гідролізу. Процес ферментативного гідролізу рослинної сировини залежить від його хімічного складу, будови і надмолекулярної структури клітинних стінок, що визначають доступ ферменту до макромолекул полісахаридів. Ферменти, що каталізують процеси розщеплення полісахаридів до більш простих з'єднань за участю води, відносять до класу гідролаз (карбогідрази): амілази, целюлази, геміцелюлази, пектинази та ін. Каталітичні параметри ферментативних реакцій можуть залежати від наявності в реакційній системі різних факторів (активатори, інгібітори, іони водню та ін.) Кислотність (рН) визначається відповідно до ГОСТ 27753.2-88. Мета роботи. Визначити рН водної витяжки зразків деревини, лушпиння і торфу. Суть методу полягає у витяганні водорозчинних речовин дистильованою водою при відношенні маси проби зразка та води 1:5 - для зразків з масовою часткою органічної речовини до 30% і 1:10 - для зразків з масовою часткою органічної речовини понад 30%. Апаратура, матеріали: - сушильна шафа, - мішалка лабораторна, - колби конічні ємністю не меньше 200 см3 по ГОСТ 25336, - мірний циліндр, - сито с сіткою диаметром 1 або 2 мм по ГОСТ 3584, - шпателі металічні або пластмасові, - папір фільтрувальний по ГОСТ 12026.
Порядок виконання роботи Пробу доводять до повітряно-сухого стану в сушильній шафі при температурі 40 ° С. Проба вважається доведеною до цього стану, якщо складові її частки не злипаються, не прилипають до твердих предметів, при роздавлюванні кришаться, порошать. Висушені проби просівають через сито з круглими отворами діаметром 1 або 2 мм. Маса проби для аналізу зразків з масовою часткою органічної речовини до 30% повинна бути 30 г, для аналізу зразків з масовою часткою органічної речовини понад 30% - 15 г. Проби зразків масою (30 ± 0,1) г або (15 ± 0,1) г поміщають в конічні колби, доливають по 150 см3 води і перемішують протягом 15 хв за допомогою електромеханічної мішалки або струшувача. Після перемішування відокремлюють по 15-20 см3 суспензії для вимірювання pH і приступають до фільтрування. Суспензії фільтрують через паперові фільтри. Першу порцію фільтрату об'ємом до 10 см3 відкидають. Каламутні фільтрати повертають на фільтри до тих пір, поки вони не стануть прозорими. Після закінчення фільтрування фільтрати перемішують і використовують для аналізу. Приклад. рН розчину становить 4,3. Обчислюємо [H +]:
Таблица 2.1. – Концентрація іонів водню водних витяжок рослинних відходів
Лабораторна робота № 3
ВИЗНАЧЕННЯ ЩІЛЬНОСТІ ЦЕЛЮЛОЗОВМІСНОЇ І ПЕНТОЗАНВМІСНОЇ РОСЛИННОЇ СИРОВИНИ 3.1 Загальні відомості
У біотехнологічних процесах широко використовуються целюлозо - і пентозанвмісна рослинна сировина: - відходи лісової і деревообробної промисловості. Значна частина деревини, заготовлюється в лісах, надходить на деревообробку. При цьому утворюється до 30% відходів від обсягу розпиляних колод, які можуть бути використані в гідролізний промисловості для отримання етилового спирту та кормових дріжджів (з деревини хвойних і листяних порід); - відходи сільського господарства (солома злакових культур, стебла кукурудзи, соняшнику, кукурудзяний качан, лушпиння соняшника, бавовни, гречки, рису, проса і ін.). Ці відходи відносять до пентозанвмісної сировини і використовують у виробництві кормових дріжджів, фурфуролу і ксиліту; - недеревинна сировина (очерет або водорості і торф). Торф із ступенем розкладання не більше 20-25% може бути використаний для промислової переробки в етиловий спирт, фурфурол, а також з нього можна отримувати віск, органічні кислоти (оцтову, щавлеву, молочну та ін), феноли, дубильні концентрати, ацетон і ін Щільність завантаження рослинних відходів при змочуванні кислотою становить, кг/м3: стрижні качанів кукурудзи 190-214; лушпиння соняшника 130-140; рисове лушпиння 100-110. Відповідно до ГОСТ 16483.1-84 визначають наступні показники щільності: - щільність при вологості в момент випробування (відношення маси зразка до його об'єму), - щільність абсолютно сухої деревини (відношення маси зразка в абсолютно сухому стані до його об'єму), - парціальна щільність (відношення маси зразка в абсолютно сухому стані до його об'єму при вологості менше межі насичення клітинних стінок), - базисна щільність (відношення маси зразка в абсолютно сухому стані до його об'єму при вологості, що дорівнює або більше межі насичення клітинних стінок).
Мета роботи. Визначити щільність деревної тирси, соняшникового лушпиння, кукурудзяних качанів та очерету при вологості в момент випробування. 3.2 Визначення щільності при вологості в момент дослідження Бюкси нумерують і зважують з похибкою не більше 0,001 г. Проби на вологість, очищені від задирок і тирси, закладають в бюкси і зважують з похибкою не більше 0,001 г. Проби, що знаходяться в бюксах зі знятими кришками, поміщають в сушильну шафу з температурою (103 ± 2) ° С. Висушування перевіряють повторними зважуваннями двох-трьох проб. Перше зважування при висушуванні м'яких порід виконують не раніше ніж через 2 години після початку висушування, а при висушуванні твердих порід - не раніше 4 г. Повторні зважування виконують через 1 г. Висушування вважається закінченим, коли різниця між двома останніми зважуваннями буде не більше 0,001 г Перед зважуванням бюкси з пробами закривають кришками і охолоджують до кімнатної температури в ексикаторі з гігроскопічним речовиною. Вологість проби (W) в процентах обчислюють з округленням не більше 0,1% за формулою:
де m0 - маса бюкси, г; m1 - маса бюкси з пробою до висушування, г; m2 - маса бюкси з пробою після висушування, г.
Таблиця 3.1. – Результати визначення вологості зразків
Щільність (СW) кожного зразка при вологості W в момент випробування обчислюють у кілограмах на кубічний метр або в грамах на кубічний сантиметр за формулою:
де mW - маса зразка при вологості W, кг (г); aW, bW, lW – розміри зразка при вологості W, м (см); VW – об’єм зразка при вологості W, м3 (см3). Результат обчислюють і округлюють 5 кг/м3 (0,005 г/см3).
Щільність кожного зразка з нормалізованої вологістю при необхідності перераховують на вологість 12% за формулою:
де K - коефіцієнт об'ємного розбухання. Для орієнтовних розрахунків коефіцієнт K може бути прийнятий рівним 0,85 • 10-3 СW при вимірі щільності в кілограмах на кубічний метр і 0,85 СW при вимірюванні в грамах на кубічний сантиметр. Щільність кожного зразка з вологістю, що відрізняється від нормалізованої, перераховують на вологість 12% за формулою:
де
Таблиця 3.2. – Коефіцієнт перерахунку
Коефіцієнт перерахунку (
для решти порід
де W - вологість зразка в момент випробування, %.
Результат обчислюють і округляють до 5 кг/м3 (0,005 г/см3).
Лабораторна робота № 4
МЕТОД БІОЛОГІЧНОЇ ТРАНСФОРМАЦІЇ ЗАБРУДНЕНЬ СТІЧНИХ ВОД 4.1 Загальні відомості Біохімічне очищення стічних вод здійснюють для видалення розчинених і колоїдних органічних речовин в процесі їх окислювання або відновлення за допомогою співтовариства мікроорганізмів (активного мулу), здатних в ході своєї життєдіяльності здійснювати їх мінералізацію. Активність мулу залежить від його віку. Він не повинен перевищувати 6-7 днів (максимальна тривалість перебування в аеротенку). Максимально допустима доза активного мулу - 3-4 г/л. На 1-ій стадії очищення в аеротенку відбувається адсорбція забруднень на поверхні активного мулу і їх коагуляція. За 0,5-2 години вміст органічних речовин зменшується на 50 %. Повітря піддається для забезпечення життєдіяльності і підтримки в зваженому стані активного мулу. На 2-ій стадії відбувається біосорбція речовин і їх окислення екзоферментами (ферменти, які виділяють в довкілля співтовариства мікроорганізмів, тобто активний мул). Завдяки зниженню концентрації забруднюючих речовин починається оновлення активного мулу. На цій стадії окислюється до 75 % органічних речовин (тривалість 2-4 години). На 3-ій стадії відбувається процес окислення ендоферментами (усередині клітини), доокислення важкоокислюваних сполук, перетворення азоту амонійних солей на нітрати і нітрити (процес йде від 4 до 6 годин). Загальна тривалість процесу в аеротенках 6-8 годин. Відстоювання стічної води після аеротенку проводять у відстійниках безперервної, напівбезперервної або періодичної дії. Відстійник є бетонним або сталевим резервуаром з вмонтованим в нього внутрішнім устаткуванням.
4.2 Мета роботи. Визначення біохімічного споживання кисню (БСК) в стічної воді. Технологічний розрахунок відстійника.
4.3 Визначення БСК в природних і стічних водах проводиться згідно з КНД 211.1.4.02-95. Біохімічне споживання кисню (БСК5) - це кількість кисню в мг, потрібна для окиснення органічних речовин, що містяться в 1 л води, аеробними бактеріями до СО2 і Н2О впродовж 5 діб без доступу повітря і світла. Перед проведенням аналізу на біохімічне споживання кисню заздалегідь визначають окиснюваність води: перманганатну (якщо вода містить незначну кількість органічних речовин), дихроматну (за умови високого вмісту органічних речовин, включно з важкоокиснюваними). Стічну воду відстоюють 2 години, розводять водою для розбавлення. Розбавлення розраховують діленням значення ХСК (мг O2/дм3) на 4. Цей результат показує, у скільки разів треба розбавити воду, що аналізується. Без розбавлення визначають БСК, від 0 до 6 мг О2/дм3. Вміст кисню в пробі після інкубації не має бути нижчим за 2-3 і вищим за 5-6 мг О2/дм3. Мінімальний об'єм відібраної проби - 10 мл; якщо потрібна менша кількість води, виконують ступінчасте розбавлення. Пробу відміряють і наливають у мірну колбу ємністю 500 мл, доливають до риски водою для розбавлення. Якщо проба розбавлена менше, ніж 1:20, її слід термостатувати. Пробу в колбі перемішують.
|

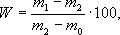 (3.1)
(3.1)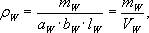 (3.2)
(3.2)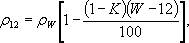 (3.3)
(3.3)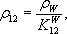 (3.4)
(3.4)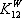 - коефіцієнт перерахунку при вологості зразків, що дорівнює або менше межі насичення клітинних стінок, який визначається за таблицею.
- коефіцієнт перерахунку при вологості зразків, що дорівнює або менше межі насичення клітинних стінок, який визначається за таблицею.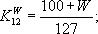 (3.5)
(3.5)


