Зонная теория.
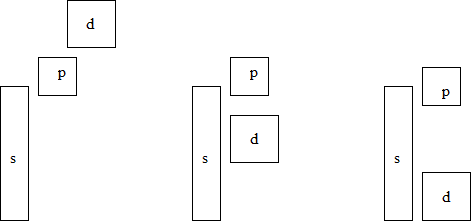
Наиболее простое и наглядное описание электронной структуры металлов дает зонная теория. В зонной теории электронное строение в кристаллической решетке металлов представляет собой результат упрощенного решения уравнения Шреденгира для многоатомной системы. Согласно зонной теории атомы металла занимают фиксированное положение в узлах кристаллической решетки. Перекрывающиеся атомные s-, d- и р-орбитали образуют соответствующие обобществленные энергетические зоны. Каждая из зон, образованная N атомами кристаллической решетки состоит из N уровней. Электроны всех атомов металла в кристалле делокализованы (обобществлены) и занимают уровни энергетических зон согласно принципу Паули, начиная с нижнего по энергии и в порядке возрастания их энергии. Низкоэнергетические зоны заполнены электронами внутренних электронных оболочек металла и не влияют на каталитические свойства металла. Для катализа важны верхние (по энергии) зоны, образованные ns-, (n-1)d- и nр-орбиталями. s-Орбитали образуют s-зону, d-орбитали образуют d-зону и р-орбитали образуют р-зону. Уровень энергии, соответствующий ВЗМО, называют уровнем Ферми (Ef; Рис. 5.34). Различие в энергиях соседних уровней в металлах мало, поэтому электроны достаточно свободно перемещаются с уровня на уровень, в том числе с заполненного уровня, лежащего ниже уровня Ферми на незаполненный уровень выше уровня Ферми, благодаря чему металлы обладают высокой проводимостью. Энергия, необходимая для перехода электрона с уровня Ферми за пределы металла (в вакуум) называется работой выхода (j; Рис. 5.34). Взаимное относительное расположение зон по энергии различно для разных металлов и изменяется в периодах слева направо так, как показано на Рисунке 5.33.
Рис. 5.33. Относительное расположение s-, p- и d-зон по энергии в металлах в зависимости от расположения в периодах периодической таблицы.
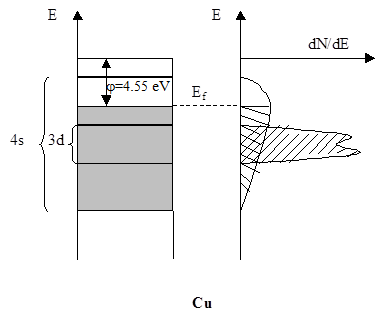
При этом s-зона имеет широкую полосу по энергии (около 20 эВ) и низкую плотность электронов (так как ей соответствует мало электронов). d-Зона гораздо уже по энергии (около 4 эВ), но имеет высокую плотность электронов, т.е. различие в энергиях уровней в d-зоне гораздо меньше, чем в s-зоне. Таким образом, s-зона перекрывает d-зону по энергии. р-Зона имеет высокий уровень энергии и остается не заполненной в переходных металлах. На Рисунке 5.34 приведены диаграммы плотности энергетических уровней (плотность состояний dN/dE) s- и d-зон и их заселенность электронами для Ni и Cu. d-Зона более узкая, перекрывается s-зоной и имеет более высокую плотность состояний. У Ni остается незаполненной часть уровней d-зоны, которые называют дырками в d-зоне(т.е. уровень Ферми (Еf) лежит ниже края d-зоны). У Cu вся d-зона полностью заполнена электронами.
Рис. 5.34. Зонная схема переходных металлов на примере Ni и Cu. j - работа выхода. Ef - уровень Ферми.
Работа выхода определяет энергию ионизации металла. В периодической системе энергия ионизации, в общем, увеличивается в рядах слева направо (Табл. 5.13), значит в этом же направлении понижается уровень Ферми.
Таблица 5.13. Работа выхода (j), первый потенциал ионизации (J) и процент d-характера связи (%d) для некоторых металлов.
Степень заполненности d-зоны, наличие дырок и уровень Ферми в переходном металле или сплаве определяет его способность к хемосорбции. Определенное количество свободных уровней и d-дырок способны к образованию связей с адсорбатом.
А б с
Рис. 5.35. Влияние адсорбции акцептора (б) и донора (с) на электронное строение металла согласно зонной модели.
На Рисунке 5.35 изображено влияние хемосорбции донорных и акцепторных молекул на электронные свойства металла с точки зрения зонной теории. На Рисунке 5.35а) изображена зонная схема для исходного состояния металла. Если адсорбат - является акцептором электронов (например О2), то для образовании связи с металлом электронная плотность передается из валентной зоны металла к адсорбату, что приводит к понижению уровня Ферми и увеличению работы выхода (Рис. 5.35,б). Чем выше степень заполнения поверхности акцепторным адсорбатом, тем ниже уровень Ферми и выше энергетический барьер для образования новых связей с адсорбатом. Следовательно, вещества с электроноакцепторными свойствами хемосорбируются легче и прочнее на металлах с высоким уровнем Ферми (т.е, расположенными в левой части периодов). При хемосорбции уровень Ферми понижается и способность к связыванию адсорбата падает с увеличением степени покрытия поверхности. Если адсорбат - является донором электронов (например Н2, СО, олефины), то при образовании связи с металлом электронная плотность передается на свободные уровни энергетических зон металла, что приводит к повышению уровня Ферми и снижению работы выхода (Рис. 5.35, в). Следовательно вещества с электронодонорными свойствами хемосорбируются легче и прочнее на металлах с высоким процентом дырок в d-зоне. При хемосорбции способность к связыванию адсорбата падает с увеличением степени покрытия поверхности, т.к. количество дырок уменьшается и растет уровень Ферми. Приведенные схемы во многих случаях объясняют общую тенденцию в изменении скорости и силы хемосорбции на металлах: - сила связывания атомарных частиц наиболее высока для металлов в левых частях рядов периодической системы; - скорость диссоциативной адсорбции на благородных металлах увеличивается справа налево, как функция заполненности d-зоны.
Например (Рис. 5.36), скорость реакции гидрирования СО на металлах 4-го периода имеет четкую зависимость от степени заполненности d-зоны. На рисунке изображена типичная вулкано-образная зависимость. С точки зрения зонной теории можно дать такое объяснение: вправо от Co количество d-дырок у металлов резко уменьшается и скорость и равновесие хемосорбции донорных реагентов (Н2 и СО) также резко снижаются, а влево от Со образуются слишком устойчивые поверхностные соединения, что также приводит к снижению скорости реакции.
Рис. 5.36. Скорость гидрирования СО на до метана на металлических катализаторах.
Таким образом, заполненность d-зоны металлов сильно влияет на их каталитические свойства. Отсюда можно сделать вывод, что сплавление каталитически активного металла с другим металлом (даже не активным в данной реакции) может изменить электронное строение катализатора и значительно изменить его каталитические свойства. Это иллюстрируется на примерах металлов 8-10 групп периодической системы, которые особенно активны в реакциях гидрирования-дегидрирования. Сплавление этих металлов с неактивными и низкоактивными металлами 11-й группы (Cu, Ag, Au) приводит к заполнению d-зоны активного металла и понижают активность в реакции гидрирования. Например добавление Cu (имеющей полностью заполненную d-зону и неактивного в реакции гидрирования непредельных углеводородов) к активным металлам гидрирования - Pd и Pt, приводит к снижению количества дырок в d-зоне активного металла, повышению уровня Ферми и снижению скорости гидрирования. И наоборот, активность Ni в реакциях гидрирования увеличивается при добавлении к нему Fe. В реакции разложения Н2О2 наблюдается противоположный эффект - сплавление с Cu приводит к повышению скорости реакции. Это объясняется тем, что в лимитирующей стадии происходит образование электроноакцепторных частиц на поверхности катализатора О- и ОН-. Сплавление с медью приводит к повышению уровня Ферми и ускорению лимитирующей стадии. Но, поскольку, ни один из факторов не действует изолированно в катализе, а может лишь в отдельных случаях быть определяющим, то, как правило, для объяснения наблюдаемых эффектов необходимо рассматривать совокупность наиболее важных факторов. Так например обстоит дело в реакциях гидрогенолиза этана и дегидрирования циклогексана катализируемых Ni, модифицированным Cu:
С2Н6 + Н2 à 2СН4 С6Н12 à С6Н6 + 3Н2
С точки зрения электронного строения, сплавление с медью должно приводить к плавному снижению скоростей этих реакций т.к. медь повышает уровень Ферми никеля и снижает процент дырок в d-зоне. Исследование адсорбции водорода показало, что общее количество водорода, как и ожидается снижается относительно монотонно (Рис. 5.37, кривая 1). А количество прочно связанного (хемосорбированного) водорода резко падает уже при концентрации меди около 15% и далее медленно снижается до нуля (Рис. 5.37, кривая 2). Эти исследования помогли сделать вывод о том, что сплав Ni/Cu не однороден и поверхность сильно обогащена медью уже при низких ее концентрациях, и концентрация меди на поверхности меняется мало в широком диапазоне соотношения металлов в сплаве (18-95%). Обогащение поверхности сплава Ni/Cu медью объясняется, в частности, более низкой поверхностной энергией меди по сравнению с никелем.
Рис. 5.37. Удельный адсорбционный объем водорода на сплавах Ni/Cu. 1 - суммарный объем; 2 - объем хемосорбированного водорода.
Учитывая этот факт становится возможным объяснить изменение скоростей гидрирования этилена и дегидрирования циклогексана при катализе сплавом Ni/Cu с изменением состава сплава (Рис. 5.38).
Рис. 5.38. Зависимость скорости дегидрирования циклогексана (1) и гидрирования этилена (2) от содержания меди в сплаве Ni/Cu.
Как видно из графиков, скорость гидрогенолиза падает на 3 порядка при добавлении всего 5% меди. Скорость же дегидрирования в этом диапазоне слегка увеличивается, а затем не меняется вплоть до чистой меди, на которой реакция вообще не идет. Резкое падение скорости гидрогенолиза этана при малых добавках меди объясняется резким снижением концентрации Ni на поверхности, т.к. для протекания данной реакции необходимо наличие соседствующих атомов никеля на которых происходит диссоциативная хемосорбция этана с разрывом С-С связи. Т.е. в данном случае основную роль играет стерический фактор. Дегидрирование циклогексана протекает через разрыв С-Н связи, которая гораздо слабее чем С-С связь, поэтому изменение электронного строения сплава не сказывается на скорости этой стации, а небольшое увеличение наблюдаемой скорости объясняют увеличением скорости десорбции бензола вследствии понижения прочности координации p-связи бензола с никелем. Т.е. в данной реакции играет роль еще и энергетический фактор. При концентрации меди в сплаве выше 80%, когда поверхностных атомов Ni становится совсем мало, скорость реакции резко падает. Влияние изменения электронных свойств на каталитическую активность наблюдается и для других сплавов. Например сплавы палладия: Pd/Ni, Pd/Ru, Pd/Pt - более активны в реакции дегидрирования циклогексана, чем чистый Pd. Этот эффект широко применяют для корректировки селективности промышленных катализаторов. Так, например, добавление небольших количеств Cu к эффективному катализатору реформинга (Ru/Os) значительно снижает его активность в реакции гидрогенолиза углеводородов, что благоприятно сказывается на селективности процесса. При гидроочистке этилена от следов ацетилена к Pd добавляют такие металлы, как Sn, Zn, Pb, Ag, Au. При этом резко снижается скорость гидрирования этилена, что значительно повышает селективность гидроочистки. В Таблице 5.14 приведены примеры изменения каталитических свойств промышленных катализаторов, сплавлением благородных металлов с другими металлами.
Таблица 5.14. Модификация каталитических свойств благородных металлов добавлением других металлов.
|