Теория Полинга.
Еще один подход к корреляции каталитических свойств с электронным строением металлов основывается на теории металлической связи по Полингу. Суть этого подхода состоит в следующем: Полинг предположил, что связь между атомами в металле образуется перекрыванием dsp-гибридизованных орбиталей. Атомы в металле могут находиться в нескольких гибридизованных состояниях, в каждом из которых в образование металлической связи включается различное количество d-гибридизованных электронов. Каждое гибридизованное состояние атома металла существует с определенной вероятностью (расчет строится на экспериментальных данных о длинах связи, энергии связи, окружении атома металла в кристаллической решетке, магнитном моменте). Из резонанса этих состояний Полинг рассчитал вес (процент) d-характера металлической связи, как отношение числа d-электронов, участвующих в металлической связи к числу связующих орбиталей. Чем выше процент d-характера металлической связи, тем меньше "дырок" - не спаренных d-электронов, остается у атома металла, а именно они участвуют в хемосорбции и определяют каталитическую активность металла. Рассмотрим пример расчета веса d-характера связи в Ni по Полингу: Из 10 валентных электронов в атоме никеля 6 участвуют в образовании металлической связи, а 4 остаются при атоме. Полинг вычислил, что атом никеля существует в кристаллическом состоянии в двух гибридизованных состояниях Ni-A и Ni-В, с вероятностью 30 и 70% соответственно. Их электронные конфигурации и тип гибридизации приведены ниже:
Ni-A: Ni-В:
Вес d-характера (вычисляется как отношения числа связывающих d-электронов к числу связующих орбиталей) в Ni-A составляет: (2-связывающих d-электрона)/(6-связывающих орбиталей) = 0,33, а в Ni-В: 3/7 = 0,43. Учитывая вероятность существования этих состояний, в среднем вес d-характера связи составляет в металлическом Ni:
%d = (30%)×0,33 + (70%)×0,43 = 40%
То есть, количество дырок в никеле составляет 0,6 на атом, что очень хорошо совпадает с экспериментально измеряемым магнитным моментом. В Таблице 5.13 приведены значения процента d-характера для переходных металлов. С процентом d-характера связи хорошо коррелирует активность металлов в реакциях гидрирования олефинов, в частности, этилена (Рис. 5.39).
Рис. 5.39. Зависимость каталитической активности переходных металлов в реакции гидрирования этилена от процента d-характера металлической связи.
В тоже время корреляция каталитической активности с весом d-характера металлической связи не обнаруживается для многих других реакций, в частности, для реакции разложения муравьиной кислоты. При сравнении зонной модели и модели Полинга становится очевидно, что dsp-гибридизованных орбитали по Полингу соответствуют заполненным уровням зонной модели. А не участвующие в металлической связи не спаренные d-электроны по Полингу соответствуют d-дыркам в зонной модели. Еще один пример, иллюстрирующий влияние электронных свойств металлических сплавов на направление и скорость реакции - гидрирование насыщенных и ненасыщенных альдегидов, катализируемое биметаллическими сплавами палладия. В реакции гидрирования двойной связи в кротоновом альдегиде экспериментально установлен следующий ряд активности металлов-модификаторов:
Ir, Co < Rh < Ni < Pt < Pd
А в реакции гидрирования карбонильной группы в масляном альдегиде ряд активности - обратный. Это объясняется следующими различиями в механизмах этих реакций: Обе реакции проходят через стадию образования одноцентровой полугидрированной промежуточной хемосорбированной частицы. Гидрирование олефиновой связи проходит через нуклеофильную атаку гидридным лигандом на углерод при двойной связи с образованием алкильного лиганда (реакция внедрения). Затем водород гетеролитически взаимодействует с этим интермедиатом давая продукт реакции и исходную форму каталитического центра:
Чем сильнее электроно-донорные свойства металла-модификатора, тем выше будет нуклеофильность водорода и выше скорость реакции. В приведенном ряду металлов-модификаторов, кроме Pt, уровень Ферми повышается слева направо (величина J уменьшается, Табл. 5.13). Но у Pt процент d-характера металлической связи меньше, чем у Pd. Гидрирование карбонильной группы проходит по механизму электрофильного присоединения протона к карбонильному кислороду:
Следовательно, чем выше электронакцепторные свойства металлов-модификаторов, тем выше электрофильность водорода, и тем выше скорость реакции. Поэтому ряд активности металлов - обратный.
|

 d2sp3 - гибридные связывающие электроны
d2sp3 - гибридные связывающие электроны d3sp2 - гибридные связывающие электроны
d3sp2 - гибридные связывающие электроны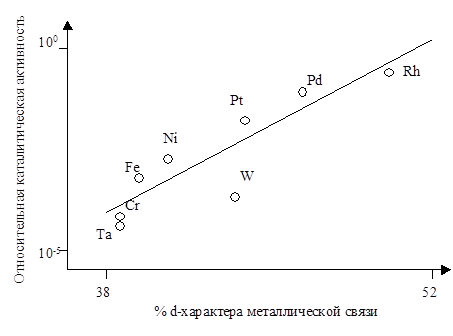
 (5.31)
(5.31) (5.32)
(5.32)


