Рассмотрим молекулу водорода с точки зрения метода молекулярных орбиталей.
Существуют  -орбитали,
-орбитали, 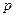 - орбитали,
- орбитали, 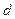 -орбитали и т.д. Для водородоподобных атомов
-орбитали и т.д. Для водородоподобных атомов  -орбиталь – это волновая функция
-орбиталь – это волновая функция 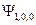 ,
, 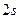 -орбиталь -
-орбиталь -  ,
, 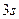 -орбиталь -
-орбиталь -  и т.д.,
и т.д., 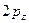 -орбиталь -
-орбиталь - 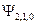 ;
; 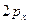 -орбиталь – это комбинация функций
-орбиталь – это комбинация функций 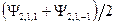 и т.д. это атомные орбитали.
и т.д. это атомные орбитали.
При сближении двух атомов водорода, находящихся в невозбужденном состоянии,  -орбитали начинают проникать друг в друга. Если спины электронов антипараллельны, то волновые функции атомов перекрывают друг друга (рис.49б) и говорят о положительном перекрывании атомных орбиталей и образовании связывающей молекулярной орбитали. Сам факт образования химической связи говорит о том, что энергия связывающей орбитали ниже исходных уровней энергии
-орбитали начинают проникать друг в друга. Если спины электронов антипараллельны, то волновые функции атомов перекрывают друг друга (рис.49б) и говорят о положительном перекрывании атомных орбиталей и образовании связывающей молекулярной орбитали. Сам факт образования химической связи говорит о том, что энергия связывающей орбитали ниже исходных уровней энергии  -атомных орбиталей (рис.50). В соответствии с принципом минимума энергии в молекуле
-атомных орбиталей (рис.50). В соответствии с принципом минимума энергии в молекуле  в основном состоянии связывающая молекулярная орбиталь заселена двумя электронами. Очевидно, что энергия связи молекулы
в основном состоянии связывающая молекулярная орбиталь заселена двумя электронами. Очевидно, что энергия связи молекулы  равна удвоенной разности энергий атомной орбитали
равна удвоенной разности энергий атомной орбитали  и связывающей молекулярной орбитали (если пренебречь межъядерным и межэлектронным отталкиванием).
и связывающей молекулярной орбитали (если пренебречь межъядерным и межэлектронным отталкиванием).
Если спины электронов сближающихся атомов водорода параллельны, то волновые функции атомов не перекрываются (рис.49в). Энергия соответствующей молекулярной орбитали, называемой разрыхляющей (антисвязывающей), лежит выше энергии  - атомной орбитали на столько же, на сколько ниже ее находится связывающая молекулярная орбиталь (рис.50). На двух молекулярных орбиталях, изображенных на рис.50 может находиться от нуля до четырех электронов. Один электрон на связывающей орбитали соответствует молекулярному иону
- атомной орбитали на столько же, на сколько ниже ее находится связывающая молекулярная орбиталь (рис.50). На двух молекулярных орбиталях, изображенных на рис.50 может находиться от нуля до четырех электронов. Один электрон на связывающей орбитали соответствует молекулярному иону 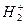 . Ион
. Ион 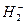 имеет 3 электрона и в соответствии с принципом Паули третий электрон должен размещаться на разрыхляющей орбитали. Разность между числом электронных пар на связывающих и антисвязывающих орбиталях, приходящаяся на одну связь, называется порядком (или кратностью) связи и является мерой прочности связи. Для молекулы
имеет 3 электрона и в соответствии с принципом Паули третий электрон должен размещаться на разрыхляющей орбитали. Разность между числом электронных пар на связывающих и антисвязывающих орбиталях, приходящаяся на одну связь, называется порядком (или кратностью) связи и является мерой прочности связи. Для молекулы  порядок связи равен 1. Экспериментально определенная энергия связи для этой молекулы составляет 436 кДж/моль. Молекулярные ионы
порядок связи равен 1. Экспериментально определенная энергия связи для этой молекулы составляет 436 кДж/моль. Молекулярные ионы 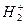 и
и 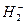 имеют порядок связи ½ и их энергии связи соответственно равны 265 и 17 кДж/моль.
имеют порядок связи ½ и их энергии связи соответственно равны 265 и 17 кДж/моль.
На рис.51 представлены связывающие и антисвязывающие орбитали, образованные  -,
-, 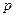 - и
- и 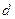 - электронами. Минимальная энергия молекулы достигается лишь при определенном перекрытии атомных орбиталей. Если АО перекрываются только одним лепестком, то говорят, что в молекуле осуществляется
- электронами. Минимальная энергия молекулы достигается лишь при определенном перекрытии атомных орбиталей. Если АО перекрываются только одним лепестком, то говорят, что в молекуле осуществляется 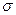 -связь. Связывающие (
-связь. Связывающие (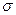 ) и антисвязывающие (разрыхляющие) (
) и антисвязывающие (разрыхляющие) (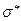 ) молекулярные орбитали, образованные
) молекулярные орбитали, образованные  -электронами обладают аксиальной симметрией – при вращении вокруг оси связи (линии, соединяющей атомы) на любой угол они совпадают сами с собой. Такие молекулярные орбитали относятся к
-электронами обладают аксиальной симметрией – при вращении вокруг оси связи (линии, соединяющей атомы) на любой угол они совпадают сами с собой. Такие молекулярные орбитали относятся к 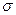 - связям. При перекрывании по два лепестка волновой функции говорят об образовании
- связям. При перекрывании по два лепестка волновой функции говорят об образовании 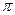 -связи.
-связи. 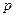 - и
- и 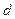 -атомные орбитали образуют как
-атомные орбитали образуют как 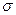 , так и
, так и 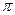 -молекулярные орбитали, совпадающие сами с собой при вращении вокруг оси связи на
-молекулярные орбитали, совпадающие сами с собой при вращении вокруг оси связи на 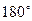 .
.

 -орбитали,
-орбитали, 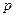 - орбитали,
- орбитали, 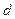 -орбитали и т.д. Для водородоподобных атомов
-орбитали и т.д. Для водородоподобных атомов  -орбиталь – это волновая функция
-орбиталь – это волновая функция 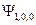 ,
, 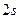 -орбиталь -
-орбиталь -  ,
, 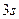 -орбиталь -
-орбиталь -  и т.д.,
и т.д., 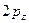 -орбиталь -
-орбиталь - 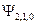 ;
; 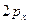 -орбиталь – это комбинация функций
-орбиталь – это комбинация функций 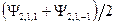 и т.д. это атомные орбитали.
и т.д. это атомные орбитали. в основном состоянии связывающая молекулярная орбиталь заселена двумя электронами. Очевидно, что энергия связи молекулы
в основном состоянии связывающая молекулярная орбиталь заселена двумя электронами. Очевидно, что энергия связи молекулы 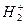 . Ион
. Ион 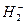 имеет 3 электрона и в соответствии с принципом Паули третий электрон должен размещаться на разрыхляющей орбитали. Разность между числом электронных пар на связывающих и антисвязывающих орбиталях, приходящаяся на одну связь, называется порядком (или кратностью) связи и является мерой прочности связи. Для молекулы
имеет 3 электрона и в соответствии с принципом Паули третий электрон должен размещаться на разрыхляющей орбитали. Разность между числом электронных пар на связывающих и антисвязывающих орбиталях, приходящаяся на одну связь, называется порядком (или кратностью) связи и является мерой прочности связи. Для молекулы 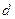 - электронами. Минимальная энергия молекулы достигается лишь при определенном перекрытии атомных орбиталей. Если АО перекрываются только одним лепестком, то говорят, что в молекуле осуществляется
- электронами. Минимальная энергия молекулы достигается лишь при определенном перекрытии атомных орбиталей. Если АО перекрываются только одним лепестком, то говорят, что в молекуле осуществляется 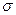 -связь. Связывающие (
-связь. Связывающие (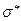 ) молекулярные орбитали, образованные
) молекулярные орбитали, образованные 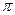 -связи.
-связи. 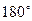 .
.


