1) Гомоядерные молекулы соответствуют второму ряду таблицы Менделеева:  . Следует заметить, что при образовании молекул перекрытие нижних слоев не дает молекулярной связи.
. Следует заметить, что при образовании молекул перекрытие нижних слоев не дает молекулярной связи.
2) Гетероядерные молекулы.
Рассмотрим молекулу фторводорода 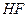 - это простейший случай гетероядерной молекулы. Электроотрицательность (т.е. мера притяжения электронов, которую проявляет атом, участвующий в ковалентной связи)
- это простейший случай гетероядерной молекулы. Электроотрицательность (т.е. мера притяжения электронов, которую проявляет атом, участвующий в ковалентной связи)  равна 2,1, а
равна 2,1, а  - 4,1. Поэтому в молекуле
- 4,1. Поэтому в молекуле 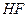 атом
атом  притягивает электроны значительно сильнее, чем атом
притягивает электроны значительно сильнее, чем атом  и связанные электроны уже не симметрично распределены между атомами, а смещены к атому фтора.
и связанные электроны уже не симметрично распределены между атомами, а смещены к атому фтора.
Электронная конфигурация атома водорода -  , атома фтора -
, атома фтора -  , следовательно перекрытие с водородом идет по одной
, следовательно перекрытие с водородом идет по одной 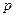 -орбитали (рис.52):
-орбитали (рис.52): 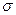 -взаимодействие
-взаимодействие  - и
- и 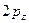 -орбиталей. Две другие орбитали фтора (
-орбиталей. Две другие орбитали фтора ( и
и 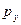 ) ориентированы перпендикулярно к оси связи и могут образовывать только
) ориентированы перпендикулярно к оси связи и могут образовывать только 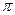 -связи, для которых у водорода нет подходящих орбиталей. В результате мы получаем схему, изображенную на рис.53:
-связи, для которых у водорода нет подходящих орбиталей. В результате мы получаем схему, изображенную на рис.53: 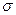 и
и 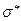 - связывающая и разрыхляющая (антисвязывающая) молекулярные орбитали и не измененные орбитали фтора -
- связывающая и разрыхляющая (антисвязывающая) молекулярные орбитали и не измененные орбитали фтора - 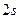 ,
,  и
и 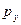 - это несвязывающие орбитали (их не надо путать с разрыхляющими орбиталями). Связывающие
- это несвязывающие орбитали (их не надо путать с разрыхляющими орбиталями). Связывающие 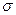 - орбитали заселены двумя электронами, и эти электроны имеют большую вероятность пребывания у атома
- орбитали заселены двумя электронами, и эти электроны имеют большую вероятность пребывания у атома  , чем у атома
, чем у атома  . Это означает, что связывающая орбиталь должна более походить на атомную
. Это означает, что связывающая орбиталь должна более походить на атомную  -орбиталь
-орбиталь  , чем на
, чем на  -орбиталь
-орбиталь  , т.е. вклад первой из них в молекулярную
, т.е. вклад первой из них в молекулярную 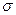 -орбиталь должен быть больше, чем второй. Поэтому атом
-орбиталь должен быть больше, чем второй. Поэтому атом  несет на себе некоторый отрицательный заряд, а атом
несет на себе некоторый отрицательный заряд, а атом  - такой же по величине положительный заряд и молекула фторводорода представляет собой диполь
- такой же по величине положительный заряд и молекула фторводорода представляет собой диполь  , где
, где  ,
,  - это степень ионности. Если
- это степень ионности. Если  , то имеем ионную связь, которая является предельным случаем ковалентной связи. Если
, то имеем ионную связь, которая является предельным случаем ковалентной связи. Если  молекула будет симметричной и это соответствует предельному случаю чисто ковалентной связи (например, атом водорода). Все гетероядерные молекулы обладают дипольным моментом, который может быть измерен экспериментально.
молекула будет симметричной и это соответствует предельному случаю чисто ковалентной связи (например, атом водорода). Все гетероядерные молекулы обладают дипольным моментом, который может быть измерен экспериментально.