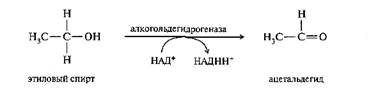
Механизм действия алкогольдегидрогеназы
Алкогольдегидрогеназа - цинксодержаший металлофермент, катализирующий окисление спиртов до альдегидов или кетонов:
В качестве кофермента алкогольдегидрогеназа, как и другие дегидрогеназы, использует НАД+. Молекула фермента, выделенного из печени лошади, представляет собой гомодимер с молекулярной массой 40 kDа. Каждая цепь имеет один сайт связывания НАД+ и два сайта связывания Zn. Внутри гидрофобного кармана в месте соединения каталитического и связывающего НАД+ находится ион Zn. Координационное число цинка равно четырем (рис.1). Окисление спиртов обусловлено формированием тройного продуктивного комплекса, причем первой стадией реакции является связывание кофермента НАД+. При образовании фермент-субстратного комплекса происходит замещение ионизированным спиртом связанной с цинком молекулы воды (рис. 2). В результате ферментативной реакции протон от субстрата переносится на кофермент и образуется ацетальдегид. В данной реакции лимитирующей стадией является диссоциация комплекса фермент - НАДН. 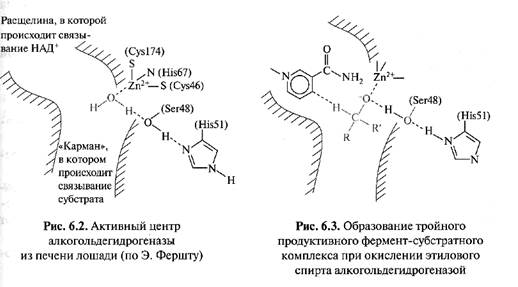
Повтор! В развитие представлений Э. Фишера американский исследователь Д. Кошланд выдвинул теорию «индуцированного соответствия». Ее суть заключается в следующем. Пока фермент не вступает во взаимодействие с субстратом, структура его активного центра лишь приблизительно комплементарна структуре субстрата; их полная комплементарность наступает лишь в момент их взаимодействия: индуцируется взаимодействием. Таким образом, выводы Э. Фишера о жестком соответствии структуры фермента и субстрата заменяются на представления о гибких, эластичных активных центрах молекул фермента. Теория Кошланда подразумевает, что конформация молекулы фермента и его активного центра может изменяться под влиянием коэнзима и субстрата.
|