Механизм ферментативной реакции
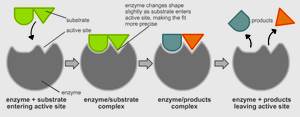
При взаимодействии фермента с субстратом можно выделить три стадии: - присоединение субстрата к макромолекуле фермента; - непосредственно ферментативная реакция; - отделение продуктов превращения субстрата от фермента. Первая стадия - самая быстрая - является лимитирующей стадией каталитического процесса в целом. Скорость ее протекания зависит от структур фермента и субстрата, природы среды, в которой осуществляется ферментативная реакция, рН и температуры. Ферменты характеризуются специфичностью по отношению к субстратам и высокой энергией связывания с ними. Эта энергия частично используется для деформации субстрата и снижения энергии активации последующей химической реакции. Взаимодействию фермента с субстратом предшествует сближение и ориентация субстрата по отношению к активному центру фермента, затем образуются фермент-субстратные комплексы. Для проявления каталитической активности совершенно необходимо, чтобы все функциональные группы фермента располагались в пространстве строго определенным образом относительно друг друга, формируя активный центр, который и обеспечивает взаимодействие с субстратом. В свое время Эмиль Фишер, говоря о том, что субстрат подходит к ферменту как «ключ к замку», предполагал, что активный центр фермента имеет совершенно жесткую структуру, комплементарную структуре субстрата. Взаимодействие фермента с субстратом вызывает локальное конформационное изменение некоторых сайтов белковой макромолекулы фермента, в результате чего комплементарность его активного центра к субстрату резко повышается и обеспечивает возможность осуществления каталитического процесса.
Модель «ключ-замок»
Как известно, структуры белка и активных центров не являются абсолютно жесткими; изменение конформации фермента под действием субстрата было впервые показано Д. Кошландом и носит название индуцированное соответствие. Согласно концепции идуцированного соответствия в исходном состоянии активный центр фермента, состоящий из остатков нескольких аминокислот, находится в «разобранном» виде. Взаимодействие и комплескообразование с субстратом приводит к изменению взаимной ориентации компонентов активного центра, в результате центр приобретает реакционноспособную конфигурацию.
Гипотеза Кошланда об индуцированом соответствии
Гибкость активного центра фермента. Активные центры ферментов расположены в шарнирных сайтах между двумя доменами. Эти сайты более лабильны, чем другие участки белковой макромолекулы, поэтому активные центры обладают повышенной чувствительностью к денатурирующим агентам, физическим факторам и протеолитическим воздействиям. Гибкость структуры активного центра является фактором, увеличивающим эффективность каталитического акта. Мгновенные переходы от одного конформационного состояния к другому, обусловленные гибкостью активного центра, являются обязательным условием реализации максимальной ферментативной активности. Фермент, в свою очередь, оказывает значительное влияние на субстрат. Под влиянием фермента структура субстрата изменяется: сначала образуется переходное состояние, а затем продукты ферментативной реакции. Оказалось, что для фермента каталитически выгодно комплементарное соответствие не основному, а переходному состоянию субстрата. Это также было доказано при помощи синтетических аналогов переходного состояния субстрата. Л. Полинг и Дж. Ходдейн предложили концепцию деформации субстрата, связанную с его модификацией под действием фермента. Однако главным является то, что субстрат в переходном состоянии взаимодействует с ферментом многократно эффективнее, чем в основном, в результате происходит более резкое снижение энергии активации ферментативной реакции. Что же касается деформации, то переходное состояние сопровождается изменением геометрии субстрата, но это не обязательно связано с процессом его деформации. Экспериментальные данные, полученные для ряда ферментов, свидетельствуют о том, что при присоединении фермента к субстрату происходит изменение ряда физико-химических показателей ферментного белка. Типы ферментативного катализа. В результате образования комплекса происходит обмен электронами и протонами между ферментом и субстратом. Если фермент отдает электронную пару субстрату, т. е. если фермент является донором электронов, осуществляющим нуклеофильную атаку, которая определяет скорость ферментативной реакции, то имеет место нуклеофильный катализ. Скорость каталитической реакции определяется электронодонорной способностью нуклеофила, т. е. тех аминокислотных остатков активного центра, которые взаимодействуют с субстратом. Относительные скорости нуклеофильной атаки зависят от энергии, необходимой для доставки электронной пары к атому субстрата. В электрофильном катализе, напротив, фермент акцептирует пару электронов от субстрата. Электрофильный катализ характерен для многих ферментов, имеющих в своем составе атомы металлов. Металлы с переменной валентностью являются электрофильными катализаторами, принимающими электронную пару. В процессе общего кислотно-основного катализа происходит перенос протона либо в пределах молекулы субстрата, либо от одного субстрата к другому. Следует отметить, что многие электро- или нуклеофильные реакции протекают более эффективно, если они сопровождаются одновременным переносом протона на субстрат. Для общего кислотно-основного катализа характерна зависимость скоростей реакций от любых кислот или оснований, находящихся в реакционной среде, в отличие от специфического кислотно-основного катализа, который зависит только от протондонорных или протонакцепторных свойств катализатора. Обобщая представления о ферментативном катализе, можно выделить следующие основные моменты. • Комплементарное присоединение субстрата к активному центру фермента является основным фактором эффективного каталитического процесса. • Комплементарность достигается за счет изменения конформации активного центра фермента под действием субстрата, а также перевода субстрата в переходное состояние, индуцируемого функциональными группировками активного центра фермента. • Эффективный активный центр фермента формируется в несколько этапов. В простейшем варианте это связано с образованием третичной структуры белка-фермента, а также достижением индуцированного соответствия определенному субстрату. В случае образования ферментов в неактивном состоянии их активация (например, за счет ограниченного протеолиза) приводит к изменению конформации, что обеспечивает взаимодействие функциональных группировок активного центра. Формирование активных центров сложных ферментов обусловлено также присоединением небелкового компонента. • Образование фермент-субстратного комплекса достигается за счет множественных контактов между ферментом и субстратом, причем чем больше этих контактов, тем эффективнее протекает каталитический процесс. • Ферментативный катализ в основном связан с обменом электронов и протонов между ферментом и субстратом или же в пределах молекулы субстрата.
|