Потенциометрия
(от лат. potentia - сила, мощность и греч. metreo - измеряю электрохим. метод исследования и анализа веществ, основанный на измерении электродвижущих сил (эдс) обратимых гальванич. элементов. П. используется для изучения кинетики и определения констант устойчивости комплексных соединений, констант диссоциации слабых кислот и оснований, а также произведения растворимости малорастворимых электролитов. П. включает редоксметрию и ионометрию. Гальванич. элемент, применяемый в П., обычно состоит из 2 электродов, к-рые помещают или в один и тот же раствор (элемент без переноса), или в 2 различных по составу раствора, имеющих между собой жидкостный контакт (элемент с переносом). Элементы без переноса используют для определения изменений термодинамич. потенциалов, энтропий, энтальпий и др. величин при разл. процессах.
8.1. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ методы анализа веществ, основанные на изучении их оптич. свойств. К О. м. и. относятся: фотометрич. методы, нефелометрия и турбидиметрия, рефрактометрия, поляриметрия, спектральный и люминесцентный анализы. К фотометрическим методам относят спектрофотометр ню и фотоколориметрию, осн. на измерении поглощения света определяемым веществом в видимой, ультрафиолетовой и инфракрасной областях спектра. Фотометрич. (абсорбционные) методы основаны па избирательном поглощении света исследуемым веществом и подчиняются закону Бугера — Ламберта — Бера (поглощение света пропорционально концентрации поглощающего вещества и толщине поглощающего слоя). При фотометрич. методах анализ проводят по поглощению монохроматич. света. Спектрофотометрия — один из наиболее точных фотометрич. методов анализа, применяемых в биохимии. Её используют для количеств. определения (с большой точностью): белков, нуклеиновых к-т, витамина А, НАД, НАДФ, 17-оксикортикостероидов в моче и плазме крови; при изучении мн. ферментов. В биохимич. исследованиях применяются спец. приборы — спектрофотометры типов СФ-4А, СФ-16 и др. Фотоколориметрию используют при исследовании ферментов (кишечная щелочная фосфатаза, альдолаза и трансаминазы сыворотки, β-глюкуронидаза и др.), глюкозы, аминокислот, белков, фосфора, железа и др. В биохимич. лабораториях чаще пользуются фотоэлектроколориметрами типа ФЭК-М и др., а также фотоэлектрич. фотометрами, снабжёнными светофильтрами. В основе нефелометрии и турбидиметрии лежит явление рассеяния или поглощения света твёрдыми или коллоидными частицами, находящимися в р-ре. Нефелометрия основана на измерении интенсивности светового потока, рассеянного твёрдыми частицами, находящимися в р-ре; турбидиметрия — на измерении ослабления интенсивности светового потока, прошедшего через р-р, содержащий твёрдые частицы
8.2. Количественный абсорбционный анализ основан на существовании зависимости между концентрацией поглощающих атомов или молекул газа и изменением интенсивности прошедшего через анализируемую газовую среду зондирующего излучения. Поглощение излучения происходит на резонансных частотах, определяемых в атомах их электронными энергетическими состояниями, а в молекулах – электронно-колебательно-вращательными состояниями. В первом случае спектр поглощения представляет–собой набор отдельных спектральных линий, а во втором – набор полос, образованных совокупностью спектральных линий. В общем виде поглощение излучения в газе описывается законом Бугера-Ламберта
где I п, I 0 – интенсивность поглощенного и зондирующего излучений; k(n) – спектральный коэффициент поглощения; L - толщина поглощающего слоя газа. 8.3. Первое описание люминесценции как специфического свечения раствора оставил в 1577 г. испанский врач и ботаник Николас Монардес. В 1852 г. Стокс установил связь между интенсивностью флуоресценции и концентрацией.
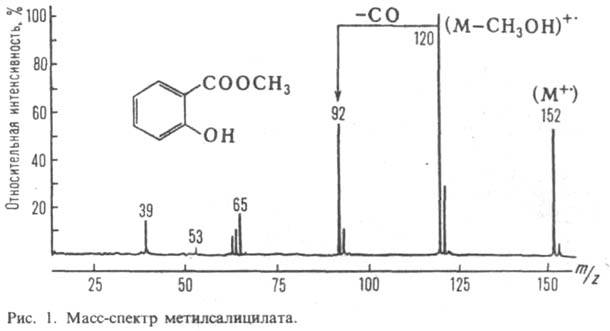
Благодаря этим особенностям достигнуты очень низкие пределы определения (до 1 ppt и ниже) и высокая селективность (например, разделение ПАУ). Анализаторы типа «Флюорат-02» являются примером доступной лабораторной аппаратуры, реализующей возможность фотолюминесцентных и хемилюминесцентных измерений. Примененные в них импульсные плазменные источники света обеспечивают высокую чувствительность, широкий спектральный диапазон и возможность кинетических измерений с разрешением по времени до 10 в –5 степени – 10 в – 6 степени секунд. Кроме того, эти приборы позволяют легко регистрировать люминесценцию при низких температурах (77к), а также могут использоваться в качестве флуоресцентного детектора в жидкостной хроматографии. Тысячи таких приборов, появившихся в лабораториях в последние годы, и десятки методик химического биохимического и микробиологического анализа, реализованных на них, являются хорошим примеров эффективности люминесцентного анализа в экологии и санитарии, водоснабжении и энергетике, пищевой и химической промышленности, медицине и других отраслях. Дальнейшее развитие методов связано с прогрессом в обработке многомерных спектров; развитием люминесцентных меток и зондов; освоением в аналитических целях новых методов возбуждения люминесценции. 9.1. Исторически задача определения элементного состава вещества решалась вначале методами аналитической химии. Затем на стыке ядерной физики, радиохимии и других дисциплин возникло новое направление - ядерно-физические методы анализа (ЯФМА). По сути это применение методов ядерной физики для определения состава вещества. В настоящее время существует большое число таких методов (более 50). Они различаются по типу бомбардирующей частицы, и разделяются на два направления по способу выделения активированных элементов: а) радиохимический (традиционный) – трудоёмок, длителен и б) инструментальный (современный), когда без всяких собственно химических методов разделения, решают задачи анализа на базе современных детекторов высокого разрешения и достижений электроники. Инструментальный анализ более экспрессен, совместим с компьютерной обработкой, более экономичен и менее трудоёмок. В целом, ядерно-физические методы анализа (ЯФМА) вещества основаны на (1) облучении исследуемых образцов потоками возбуждающего излучения (нейтроны, заряженные частицы, g-кванты) и затем (2) регистрации возникающего вторичного излучения атомов образца. ЯФМА относится к классу методов элементного анализа вещества, результатом которых является количественное определение содержания искомого элемента в образце независимо от его химических связей. 9.3. МАСС-СПЕКТРОМЕТРИЯ (масс-спектроскопия, масс-спектральный анализ), метод анализа в-ва путем определения массы (чаще, отношения массы к заряду m/z) и относит. кол-ва ионов, получаемых при ионизации исследуемого в-ва или уже присутствующих в изучаемой смеси. Совокупность значений m/z и относит. величин токов этих ионов, представленная в виде графика или таблицы, наз. масс-спектром в-ва (рис. 1). 9.5. РЕНТГЕНОВСКАЯСПЕКТРОСКОПИЯ, раздел спектроскопии, изучающий спектры испускания (эмиссионные) и поглощения (абсорбционные) рентгеновского излучения, т.е. электромагн. излучения в области длин волн 10-2-102 нм. Рентгеновскую спектроскопию используют для изучения природы хим. связей и количеств. анализа в-в (рентгеновский спектральный анализ). С помощью рентгеновской спектроскопии можно исследовать все элементы (начиная с Li) в соед., находящихся в любом агрегатном состоянии. Рентгеновские спектры обусловлены переходами электронов внутр. оболочек атомов. Различают тормозное и ха-рактеристич. рентгеновское излучение. Первое возникает при торможении заряженных частиц (электронов), бомбардирующих мишень в рентгеновских трубках, и имеет сплошной спектр. Характеристич. излучение испускают атомы мишени при столкновении с электронами (первичное излучение) или с рентгеновскими фотонами (вторичное, или флуоресцентное, излучение). В результате этих столкновений с одной из внутр. (К-, L- или М-) оболочек атома вылетает электрон и образуется вакансия, к-рую заполняет электрон с другой (внутр. или внеш.) оболочки. При этом атом испускает квант рентгеновского излучения. Принятые в рентгеновской спектроскопии обозначения переходов приведены на рис. 1. Все уровни энергии с главными квантовыми числами n = 1, 2, 3, 4... обозначаются соотв. К, L, M, N...; подуровням энергии с одним и тем же h приписывают последовательно числовые индексы в порядке возрастания энергии, напр. M1, М2, М3, M4, M5 (рис. 1). Все переходы на К-, L- или М-уровни называют переходами К-, L- или М-серии (К-, L- или М-переходами) и обозначают греческими буквами (a, b, g...) с числовыми индексами. Общепринятых рацион. правил обозначения переходов не существует. Наиб. интенсивные переходы происходят между уровнями, удовлетворяющими условиям: Dl = 1, Dj = 0 или 1 (j = = lb 1/2), Dn. 0. Характеристич. рентгеновский спектр носит линейчатый характер; каждая линия соответствует определенному переходу.
Рис. 1. Важнейшие рентгеновские переходы. Поскольку бомбардировка электронами вызывает распад в-ва, при анализе и изучении хим. связей применяют вторичное излучение, как, напр., в рентгеновском флуоресцентном анализе (см. ниже) и в рентгеноэлектронной спектроскопии. Только в рентгеновском микроанализе (см. Электронно-зондовые методы)используют первичные рентгеновские спектры, т.к. пучок электронов легко фокусируется. Схема прибора для получения рентгеновских спектров приведена на рис. 2. Источником первичного рентгеновского излучения служит рентгеновская трубка. Для разложения рентгеновского излучения в спектр по длинам волн используют кристалл-анализатор или дифракц. решетку. Полученный спектр рентгеновского излучения регистрируют на рентгеновской фотопленке, с помощью ионизац. камеры, спец. счетчиками, полупроводниковым детектором и т. д. Рентгеновские спектры поглощения связаны с переходом электрона внутр. оболочки на возбужденные оболочки (или зоны). Для получения этих спектров тонкий слой поглощающего в-ва помещают между рентгеновской трубкой и кристаллом-анализатором (рис. 2) или между кристаллом-анализатором и регистрирующим устройством. Спектр поглощения имеет резкую низкочастотную границу, при к-рой происходит скачок поглощения. Часть спектра до этого скачка, когда переход происходит в область до порога поглощения (т.е. в связанные состояния), наз. ближней структурой спектра поглощения и носит квазилинейчатый характер с хорошо выраженными максимумами и минимумами. Такие спектры содержат информацию о вакантных возбужденных состояниях хим. соединений (или зонах проводимости в полупроводниках).
Рис. 2. Схема рентгеновского спектрометра: 1-рентгеновская трубка; 1а-источник электронов (термоэмиссионный катод); 1б-мишень (анод); 2-исследуемое в-во; 3 - кристалл-анализатор; 4-регистрирующее устройство; hv1-первичное рентгеновское излучение; hv2 - вторичное рентгеновское излучение; hv3 - регистрируемое излучение. 9.6. ЭЛЕКТРОННАЯМИКРОСКОПИЯ, совокупность электронно-зондовых методов исследования микроструктуры твердых тел, их локального состава и микрополей (электрических, магнитных и др.) с помощью электронных микроскопов (ЭМ) - приборов, в к-рых для получения увелич. изображений используют электронный пучок. Электронная микроскопия включает также методики подготовки изучаемых объектов, обработки и анализа результирующей информации. Различают два гл. направления электронной микроскопии: трансмиссионную (просвечивающую) и растровую (сканирующую), основанных на использовании соответствующих типов ЭМ. Они дают качественно разл. информацию об объекте исследования и часто применяются совместно. Известны также отражательная, эмиссионная, оже-электронная, лоренцова и иные виды электронной микроскопии, реализуемые, как правило, с помощью приставок к трансмиссионным и растровым ЭМ. Трансмиссионная микроскопия реализуется с помощью трансмиссионных (просвечивающих) электронных микроскопов (ТЭМ; рис. 1), в к-рых тонкопленочный объект просвечивается пучком ускоренных электронов с энергией 50-200 кэВ. Электроны, отклоненные атомами объекта на малые углы и прошедшие сквозь него с небольшими энергетич. потерями, попадают в систему магн. линз, к-рые формируют на люминесцентном экране (и на фотопленке) светлопольное изображение внутр. структуры.
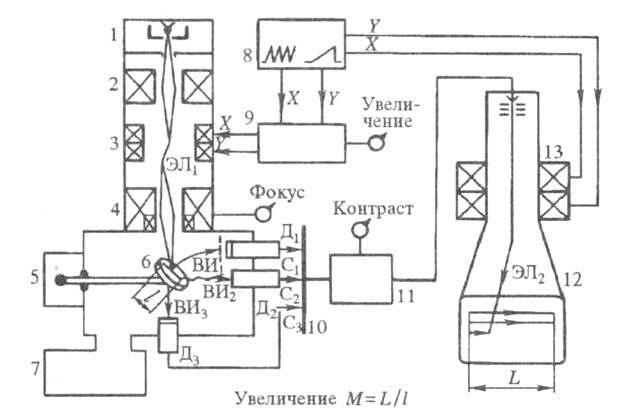
Рис. 1. Схема устройства трансмиссионного электронного микроскопа: 1 - электронная пушка; 2 - конденсор; 3 -образец; 4, 5- объектив и его диафрагма; 6, 7- промежуточная и проекционная линзы; 8 -смотровое окно; 9 - люминесцентный экран; 10 - фотокамера с затвором; 11 - вакуумная система. Для анализа металлич. фольги, а также толстых (1-3 мкм) срезов др. материалов используют высоко- и сверхвысоковольтные ТЭМ с ускоряющими напряжениями соотв. 200-300 и 1000-3000 кВ. Это позволяет снизить энергетич. потери электронов при просвечивании образцов и получить четкие изображения, свободные от хроматич. аберрации. Растровая (сканирующая) микроскопия. В растровых электронных микроскопах (РЭМ; рис. 2) электронный луч, сжатый магн. линзами в тонкий (1-10 нм) зонд, сканирует пов-сть образца, формируя на ней растр из неск. тыс. параллельных линий. Возникающее при электронной бомбардировке пов-сти вторичные излучения (вторичная эмиссия электронов, оже-электронная эмиссия и др.) регистрируются разл. детекторами и преобразуются в видеосигналы, модулирующие электронный луч в ЭЛТ. Развертки лучей в колонне РЭМ и в ЭЛТ синхронны, поэтому на экране ЭЛТ появляется изображение, представляющее собой картину распределения интенсивности одного из вторичных излучений по сканируемой площади объекта. Увеличение РЭМ определяется как М = L/l, где L и l - длины линий сканирования на экране ЭЛТ и на пов-сти образца.
Рис. 2. Схема устройства растрового электронного микроскопа: 1 - электронная пушка; 2 - конденсор; 3 - отклоняющая система; 4 - конечная линза с корректором астигматизма; 5 - объектный столик; 6 - образец; 7 - вакуумная система; 8 - генератор разверток; 9 - блок управления увеличением; 10 -селектор сигналов (для выбора регистрируемого вторичного излучения); 11 -видеоусилитель; 12,13 - ЭЛТ и ее отклоняющая система; BИ1-BИ3 - потоки вторичных излучений; C1 - C3 - электрич. сигналы; Д1-Д3 - детекторы; ЭЛ1, ЭЛ2 - электронные лучи; X, Y - направления сканирования (строчная и кадровая развертки). 6.1. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. Хроматография – процесс, основанный на многократном повторении актов сорбции и десорбции вещества при перемещении его в потоке подвижной фазы вдоль неподвижного сорбента. Разделение сложных смесей хроматографическим способом основано на различной сорбируемости компонентов смеси. В процессе хроматографирования так называемая подвижная фаза (элюент), содержащая анализируемую пробу, перемещается через неподвижную фазу. Обычно неподвижная фаза представляет собой вещество с развитой поверхностью, а подвижная – поток газа или жидкости, фильтрующейся через слой сорбента. При этом происходит многократное повторение актов сорбции – десорбции, что является характерной особенностью хроматографического процесса и обуславливает эффективность хроматографического разделения. Классификация По агрегатному состоянию применяемых фаз. Согласно этой классификации хроматографию подразделяют на газовую и жидкостную. Газовая включает газо-жидкостную и газо-адсорбционную хроматографию. Жидкостная хроматография подразделяется на жидкостно – жидкостную, жидкостно – адсорбционную и жидкостно – гелевую. Первое слово в этой классификации характеризует агрегатное состояние подвижной фазы. По механизмам разделения, т.е. по характеру взаимодействия между сорбентом и сорбатом. По этой классификации хроматографию подразделяют на следующие виды: 1. адсорбционная хроматография – разделение основано на различии в адсорбируемости разделяемых веществ твердым адсорбентом; 2. распределительная хроматография – разделение основано на различии в растворимости разделяемых веществ в неподвижной фазе (газовая хроматография) и на различии в растворимости разделяемых веществ в подвижной и неподвижной жидких фазах; 3. ионообменная хроматография – разделение основано на различии в способности разделяемых веществ к ионному обмену; 4. проникающая хроматография – разделение основано на различии в размерах или формах молекул разделяемых веществ, например, при применении молекулярных сит (цеолитов); 5. осадочная хроматография – разделение основано на образовании различных по растворимости осадков разделяемых веществ с сорбентом; 6. адсорбционно-комплексообразовательная хроматография – разделение основано на образовании координационных соединений различной прочности в фазе или на поверхности адсорбента. По применяемой технике: 1) колоночная хроматография – разделение веществ проводится в специальных колонках; 2) плоскостная хроматография: а – бумажная – разделение веществ проводится на специальной бумаге; б – тонкослойная – разделение веществ проводится в тонком слое сорбента. В колоночной и тонкослойной хроматографии можно использовать любой из приведенных выше механизмов разделения, в бумажной хроматографии чаще всего применяют распределительный и ионообменный механизмы. По способу относительного перемещения фаз различают фронтальную, или элюэнтную, и вытеснительную хроматографию. Фронтальный метод. Это простейший по методике вариант хроматографии. Он состоит в том, что через колонку с адсорбентом непрерывно пропускают анализируемую смесь, например, компонентов А и В в растворителе Solv. В растворе, вытекающем из колонки, определяют концентрацию каждого компонента и строят график в координатах концентрация вещества – объем раствора, прошедшего через колонку. Эту зависимость обычно и называют хроматограммой или выходной кривой. Вследствие сорбции веществ А и В сначала из колонки будет вытекать растворитель Solv, а затем растворитель и менее сорбирующийся компонент А, затем и компонент В и, таким образом, через некоторое время состав раствора при прохождении через колонку меняться не будет. Метод применяется, например, для очистки раствора от примесей, если они сорбируются существенно лучше, чем основной компонент, или для выделения из смеси наиболее слабо сорбирующегося вещества. Проявительный (элюентный) метод. При работе по этому методу в колонку водят порцию анализируемой смеси, содержащей компоненты А и В в растворителе Solv, и колонку непрерывно промывают газом-носителем или растворителем Solv. При этом компоненты анализируемой смеси разделяются на зоны: хорошо сорбирующееся вещество В занимает верхнюю часть колонки, а менее сорбирующийся компонент А будет занимать нижнюю часть. В газе или растворе, вытекающем из колонки, сначала появляетсякомпонент А, далее – чистый растворитель, а затем компонент В. Чем больше концентрация компонента, тем выше пик и больше его площадь, что составляет основу количественного хроматографического анализа. Проявительный метод дает возможность разделять сложные смеси, он наиболее часто применяется в практике. Недостатком метода является уменьшение концентрации выходящих растворов за счет разбавления растворителем или газом-носителем. Вытеснительный метод. В этом методе анализируемую смесь компонентов А и В в растворителе Solv вводят в колонку и промывают раствором вещества D (вытеснитель), которое сорбируется лучше, чем любой из компонентов анализируемой смеси. Концентрация раствора при хроматографировании не уменьшается, в отличие от проявительного метода. Существенным недостатком вытеснительного метода является возможное наложение зоны одного вещества на зону другого, поскольку зоны компонентов в этом методе не разделены зоной растворителя. В хроматографии чаще всего используют методику проявительного (элюентного) анализа, в этом случае наблюдаемый пик в координатах концентрация - объем называют хроматографическим пиком и характеризуют высотой, шириной и площадью.
|


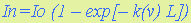 (VI 1)
(VI 1)