ЭНАНТИОСЕЛЕКТИВНОЕ ПАЛЛАДИЙ-КАТАЛИЗИРУЕМОЕ АМИНИРОВАНИЕ ДИЭТИЛ АМИНОМЕТИЛФОСФОНАТОМ – НОВЫЙ ПОДХОД К СИНТЕЗУ ПОТЕНЦИАЛЬНО БИОАКТИНЫХ СОЕДИНЕНИЙ
Жеглов С.В.,1 Гулюкина Н.С.2,Белецкая И.П.3 1 Рязанский государственный университет имени С.А. Есенина, Рязань, Россия. Молодой учёный. s.zheglov@rsu.edu.ru 2 Московский Государственный Университет имени М.В.Ломоносова, Москва, Россия.. 3 Московский Государственный Университет имени М.В.Ломоносова, Москва, Россия.. Научный руководитель: Гаврилов К.Н.
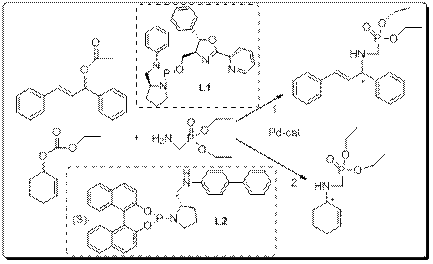
Диэтил аминометилфосфонат является структурным аналогом природной аминокислоты – глицина. Замена карбоксильной группы на фосфонатную приводит к тому, что производные α-аминоалкилфосфосфоновых кислот проявляют ингибирующий эффект по отношению к ферментам или рецепторам, с которыми обычно связываются природные аминокислоты. Разработанный удобный метод получения соединений с высокой степенью оптической чистоты, позволяет провести детальное исследование их биоактивности, что впоследствии может привести к созданию новых эффективных лекарственных препаратов. Диэтил аминометилфосфонат был синтезирован в 4 стадии из доступных реагентов на основе известных литературных методик. Он был использован в качестве нуклеофила в Pd-катализируемых процессах аминирования (E)-1,3-дифенилаллилацетата и 2-циклогексен-1-илэтилкарбоната.
Реакции проводились по стандартной методике: 20ºС, 48 часов, CH2Cl2, 2 mol % [Pd(allyl)Cl]2 в качестве предкатализатора. Строение выделенных рацемических продуктов модельных реакций было доказано спектральными данными ЯМР 1Н и ЯМР 13С. Энантиомерный анализ был осуществлен методом ВЭЖХ с использованием колонки Kromasil® 5-CelluCoat. В асимметрическом варианте процесса 1 в качестве стереоиндукторов были использованиы хиральные лиганды фосфитной природы L1 и L2. При этом с использованием L1 было достигнуто до 91% энантиомерного избытка при конверсии исходного ацетата 55%, а с использованием L2 до 98% ее при 50%-ной конверсии.
Работа выполнена при финансовой поддержке РФФИ (грант № 11-03-00347-а)
|