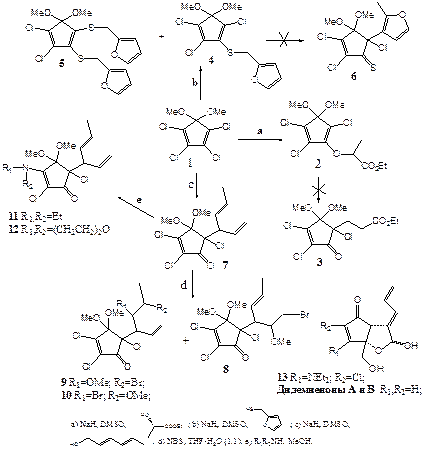СИНТЕЗ НОВЫХ С-, N- И S-ФУНКЦИОНАЛИЗИРОВАННЫХ ПРОИЗВОДНЫХ 5,5-ДИМЕТОКСИТЕТРАХЛОРЦИКЛОПЕНТАДИЕНА
Егоров В.А. Институт органической химии УНЦ РАН, 450054, Россия, г. Уфа, просп. Октября 71, Уфа, Россия. Молодой учёный. AMONIKA@mail.ru Научный руководитель: Халиков Р. М.
Циклопентеноновые структуры очень распространены в живой природе и обладают широким диапазоном биологической активности (антивирусной, антибактериальной, фунгицидной и др.), что обусловлено группировкой α,β-ненасыщенного кетона, способной к ковалентному связыванию по реакции Михаэля с SH- или NH2 -функциональными группами биосистем. С целью расширения синтетического ассортимента подобных соединений нами изучены реакции 5,5-диметокситетрахлорциклопентадиена 1 с ненасыщенными спиртами, этиловым эфиром L-молочной кислоты и фурфурилмеркаптаном, в условиях синтеза аналогичных структур.
Реакция 1 с этиловым эфиром L-молочной кислоты и фурфурилмеркаптаном не приводила к ожидаемым продуктам 3 и 6, из-за высоких энергетических барьеров при протекании перегруппировки Кляйзена интермедиатных соединений 2 и 4. Взаимодействием диена 1 сфурфурилмеркаптаном в ДМСО в присутствии NaH в качестве основного продукта образовалось дизамещенное производное 5, а в качестве минорного – аддукт монозамещения 4 в соотношении 2:1. На базе диенового производного 7, полученного реакцией 5,5-диметокситетрахлорциклопентадиена 1 с натрийпроизводным сорбинового спирта, планировалось получить N -содержащие аналоги типа 13 природных дидемненонов А и В, содержащих боковой экзо -1,3-диенильный фрагмент и обладающих высокой антибактериальной и антифунгальной активностью. Введение N -заместителя при С3 диена 7 протекало гладко в стандартных условиях N -кетовинилирования подобных систем: взаимодействие с Et2NH или морфолином в МеОН привело к получению продуктов 11 и 12 соответственно. Для превращения бокового 1,4-гексадиенового фрагмента 7 в пентадиеналь 13 реакцией с NBS, получены смеси соединений 8 и 9, 10. Дальнейшее проведение стадии селективного озонолитического расщепления терминальной двойной связи и последующего отщепления MeOH и HBr в соединениях 9, 10 было сильно осложнено необходимостью хроматографического разделения смеси полученных синтонов 8 и 9, 10.
|