Реакции, основанные на использовании органических аналитических реагентов
В качественном и количественном химическом анализе широко используются многие типы реакций с участием органических реагентов, содержащих различные ФАГ и ААГ. Реакции осаждения. По сравнению с неорганическими осадителями ОАР имеют ряд преимуществ: ü способствуют снижению предела обнаружения. Органический осадитель обладает большой молекулярной массой при относительно небольшом содержании осаждаемого неорганического иона, что приводит к уменьшению гравиметрического фактора. Гравиметрический фактор определяется отношением молекулярной либо атомарной, либо ионной массы определяемого вещества к молекулярной массе гравиметрической формы с соответствующими стехиометрическими коэффициентами; ü регулируя рН можно порой достичь не только селективного, но и специфического осаждения ионов; ü образуются негигроскопичные осадки.
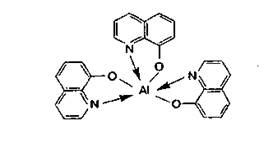
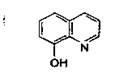
К первой группе относятся хелатообразующие реагенты (8-гидро-ксихинолин, диметилглиоксим, 1-нитрозо-2-нафтол), в результате действия которых образуются осадки неионного характера. Хелатами, как известно, называют циклические комплексные соединения ионов металлов с лигандами, способными присоединяться к этому иону более чем двумя связями. В случае взаимодействия 8-гидроксихинолина с ионами алюминия получается хелат: Часто растворимость образовавшихся комплексных соединений зависит от рН среды.
Например. 1) В зависимости от рН раствора 8-гидроксихииолии C9H6N(OH):
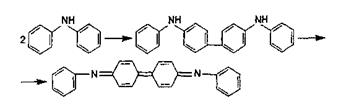
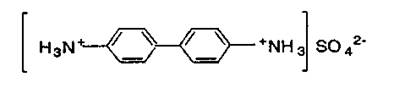
2) Диметилглиоксим (реактив Чугаева) в кислой среде осаждает только ионы Pd2+; в аммиачной среде с ионами Ni2+ образует осадок розового цвета, а с ионами Fe2+ — соединение темно-красного цвета; при рН 11 осаждает ионы Bi3+. Вторую группу составляют солеобразующие реагенты, при участии которых выпадают в осадок малорастворимые комплексы с ионной связью (между неорганическим ионом и ОАР). Это тетрафенилборат натрия NaB (C6H5)4 — реагент на ионы NH4+, K+, Rb+ Cs+; бензидин, осаждающий сульфат-ионы в кислой среде в виде:
Реакции образования окрашенных комплексов. Важной характеристикой комплексообразующих ОАР является избирательность реакций. Количественно избирательность реакций оценивается отношением констант устойчивости комплексов соответствующих металлов. Устойчивость комплексов металлов с органическими лигандами, в свою очередь, зависит от природы металла и донорных атомов лигандов. В химическом анализе используют не только осаждение окрашенных комплексов, но и образование окрашенных комплексных соединений в результате адсорбции реагента на поверхности осадка. За счет комплексообразования изменяется электронная структура ФАГ органического реагента, что влечет за собой изменение области поглощения света.
Например. Родизонат натрия Na2C6О6 с ионами Ва2+ образует осадок в виде комплекса красно-бурого цвета (при подкислении осадок становится розово-красным):
Данная реакция позволяет определить в присутствии ионов стронция 0,25мкг ионов бария.
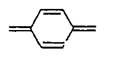
Хромофорными группами, поглощающими свет в видимой области электромагнитного излучения, являются группы, в составе которых присутствуют атомы N, P, S, О, а также группы >C=N-, -N=N- и др., причем особое значение имеет образование хиноидных структур:
Усиление интенсивности окраски в присутствии хромофорных групп возможно при наличии так называемых ауксохромных групп атомов (-ОН-, -NH2, -0-CH3 и др.).
Окислительно-восстановительные реакции. Для качественного и количественного определения неорганических ионов-окислителей (NО3-, NО2-, ClО3-, MnО4- и др.) в аналитической химии нередко используют ОАР, обладающие окислительно-восстановительными свойствами. При комбинировании окислительно-восстановительной пары и определении возможности протекания редокс-реакции пользуются значениями стандартных окислительно-восстановительных потенциалов ОАР ( В ходе аналитической реакции определяемый ион-окислитель будет восстанавливаться, а ОАР окисляться при условии, если ( Например. Бесцветный дифениламин (C6H5)2NH в кислой среде окисляется ионами NО3- до хиноидного соединения темно-синего цвета:
Аналогично с дифениламином реагируют и другие ионы-окислители.
Реакции, характерные только для органических реагентов. В аналитической химии, в зависимости от цели исследования, находят применение разные типы реакций. Например. 1) Определение ионов NО2- в дождевой воде (в грозовых рязря-дах происходит превращение свободного азота в нитрит-анионы) основано на проведении реакции диазотирования с нитрит-ионами с последующим применением реакции сочетания, в результате которой из соли диазония получается интенсивно окрашенное соединение:
2) Качественной реакцией на ацетат-ионы является реакция этерификации. В присутствии серной кислоты уксусная кислота и ее соли под действием спиртов образуют сложные эфиры с характерным запахом эссенций.
|



 ) и определяемых неорганических ионов (
) и определяемых неорганических ионов ( ).
).