Метод травления 2 страница
Печи сопротивления получили широкое распространение из-за их надежности, простоты оформления и широкого диапазона температур от комнатной до 3000 оС. Недостатком печей накала является большая инерционность (для их охлаждения требуется около двух часов), опасность загрязнения кристалла со стенок печей и их плохая воспроизводимость. Для долее высокого нагрева пользуются радиационной печью. Ее можно сделать в виде цилиндра (в идеальном случае в виде сферы), полированные стенки которого хорошо отражают падающее на них излучение. Разогрев обеспечивают нагревательным элементом в виде кольцеобразной обоймы из кварцевых или пирофиллитовых стержней, на которые натянута проволока. Образец и термопару размещают вблизи центра цилиндра. Для такой печи характерна низкая теплоемкость и высокая чувствительность к изменению мощности. В последние годы все чаще используется аппаратура с индукционным, или высокочастотным, нагревом. При быстром изменении магнитного поля, пронизывающего нагреваемый объект, на поверхности последнего наводятся индукционные токи. Индукционные токи протекают преимущественно вдоль поверхности объекта и выделяемое тепло передается вглубь лишь за счет теплопроводности материала. Индукционный, или высокочастотный, нагрев в аппаратурном оформлении не сложнее печей сопротивления. Преимущество такого нагрева и в том, что опасность загрязнения материала сводится к минимуму. В ряде случав используются такие способы нагрева, как электрической дугой, создание сверхвысоких температур (более 15 000 оС) плазменным шнуром, нагрев катодными лучами и нагрев до 3500 оС фокусированным тепловым излучением (солнечные печи).
2. Во всех системах необходимо надежное измерение температуры, которое давало бы гарантию успеха в выращивании монокристаллов. Для этой цели разработан ряд приборов: жидкостные термометры, пирометры.
Действие жидкостных термометров основано на свойстве жидкости расширяться при нагреве. В интервале измеряемых температур от –30 оС до + 600 оС используется ртуть, от –300 оС до + 100 оС – толуол, от –80 оС до + 80 оС – этиловый спирт и др. Общеизвестны ртутные контактные термометры, в которых нагревающаяся ртуть, расширяясь, поднимается по трубке, касается подвижного контакта и замыкает цепь реле, отключающего нагреватель. При остывании опускающаяся ртуть размыкает реле и электронагревательвключается. Для изменения контролируемой температуры достаточно поднять или опустить подвижный контакт в капиллярной трубке терморегулятора. Действие термометров сопротивления основано на зависимости электросопротивления от температуры. Эти термометры определяют температуру с большой точностью. Используемые металлы должны иметь высокий температурный коэффициент удельного сопротивления Наиболее широкое применение получили термопары. Они механически прочнее и просты в работе. Действие их основано на возникновении э.д.с. в местах контакта (спая) двух проводников различного состава и э.д.с. в проводнике, концы которого поддерживаются при разных температурах. Величина э.д.с. определяется природой металла и разностью температур между холодным и горячим спаями и не зависит от длины проводов. Для отсчета температуры существуют градуированные таблицы или кривые. Необходимо, чтобы температура свободных концов была равна той, при которой производится градуировка термопар. При градуировке холодный спай должен поддерживаться при температуре 0 оС. Вообще говоря, для измерения температуры можно воспользоваться любой парой металлов, однако практически важным условиям – неизменности показаний во времени и воспроизводимости – удовлетворяют лишь немногие из них. Желательно также, чтобы величина возбуждаемой э.д.с. зависела от температуры линейно. Широко используются термопары хромель-алюмелевые (ХА), хромель-капелевые, платино-платино-родиевые (ПП) и др. Для высокотемпературных измерений можно воспользоваться оптическим пирометром. Действие его основано на изменении цвета излучения в зависимости от температуры. Ниже температуры 500 оС излучение находится за пределами видимости; тусклый красный цвет соответствует 600 оС; красный – 700 оС; светло-красный – 800 оС; вишнево-красный – 900 оС; оранжево-красный – 1000 оС; оранжевый – 1100 оС; белое свечение – выше 1600 оС. В большинстве случаев цвет исследуемого тела сравнивают с эталоном. Для этой цели изготавливаются специальные пирометры с исчезающей нитью. 3. В практике выращивания кристаллов особое значение придается поддержанию постоянства температуры печи. Стабильность температуры (максимальная ± 0,5 оС) наряду с другими условиями обеспечивает монокристальный рост, совершенство кристалла и его стехиометрический состав. Колебания температуры печи могут вызываться непостоянством питающего напряжения, изменениями температуры окружающей среды, повреждениями обмотки или теплоизоляции печи. Если источник питания стабилизирован, то тем самым колебания температуры в печи в зависимости от типа стабилизатора не выходят за пределы ± 0,5 - ± 1 оС. В лучших стабилизаторах выходное напряжение второго трансформатора непрерывно и автоматически корректируется посредством специальной схемы. Для обеспечения высокой точности поддержания температуры применяют следящие системы – устройства, в которых данные о температуре печи передаются питающему элементу. Если температура печи ниже заданной, то автомат усиливает подачу энергии; в обратном случае вся энергия или часть ее снимается. В качестве контролирующего элемента могут быть использованы термометры сопротивления или термопары. Эффективность регулирования температуры зависит от теплоемкости печи. Печь с очень большой теплоемкостью в малой степени реагирует на изменение температуры окружающей среды и более заметно, но медленно реагирует на изменения силового питания. Лучше всего такая печь работает при относительно низких температурах. Печь с очень малой теплоемкостью подвержена воздействию окружающей среды, но зато обладает быстрой реакцией и более пригодна для высокотемпературных процессов.
4) Материалы сосудов и тиглей
Сосуды, заключающие расплав, называют тиглями, лодочками. В ряде случае выращиваемый из расплава монокристалл принимает форму заключающего его сосуда. К материалу тигля предъявляется ряд требований: 1) кристаллизуемое вещество не должно при соприкосновении с материалом тигля вступать с ним в химическую реакцию; 2) не должно прилипать к стенкам сосуда; 3) материал тигля не должен размягчаться при температуре, превышающей примерно на 100 оС температуру плавления кристаллизуемого вещества; 4) теплопроводность тигля желательна по возможности большая, но не должна превышать теплопроводность кристаллизуемого вещества; 5) упругость паров материала тигля должна быть в условиях кристаллизации не очень высокой, в противном случае срок службы тигля будет исчисляться немногими часами; 6) чистота тигля не должна уступать чистоте кристаллизуемого вещества. Для изготовления тиглей чаще всего используют плавленый кварц, стекло, платину, графит, окись алюминия, тугоплавкие окислы (окись бериллия, окись магния, двуокись циркония, двуокись тория), сталь, молибден и другие тугоплавкие металлы, огнеупорные материалы. Весьма распространен в качестве тигельного материала плавленый кварц. Он инертен к большей части элементов и соединений. Исключение составляют основные окислы и фториды. Кварц выдерживает нагрев до 1200 оС. Чрезвычайно малый коэффициент расширения обеспечивает его хорошую термическую стойкость. Толстостенные кварцевые тигли выдерживают давление до 10 атм. Кварц вообще очень чистый материал: лучшие сорта содержат лишь десятитысячные доли процента натрия, кальция, алюминия, фосфора, мышьяка, бора и иногда железа, меди и кобальта. Поверхность кварца легко сделать чистой и гладкой. Важнейшее преимущество плавленого кварца в том, что ему можно придать самую разнообразную форму, обеспечивающую при необходимости полную герметизацию всей системы. Кварц не взаимодействует со всеми обычными кислотами, за исключением плавиковой, но энергично реагирует с концентрированными щелочами, поэтому в контакте со щелочными веществами его применять не следует. Некоторые расплавленные металлы сильно прилипают к кварцу, однако смачивание металлов можно ослабить, если кварц покрыть слоем сажи. Так, кварцевую лодочку часто покрывают сажей, выдерживая ее в коптящем пламени бензола или парафинового воска. Аналогичные результаты можно получить споласкиванием трубки в ацетоне или спирте с последующим нагреванием до 600 – 700 оС. Органическое вещество, сгорающее при ограниченном доступе воздуха, образует тонкий, но очень стойкий и прочно удерживаемый слой углерода. Для футеровки кварцевых тиглей также применяют графитовый порошок. Любое расширение передается слою графита, легко деформирующемуся вследствие своей мягкости. Стекло – тоже широко распространенный тигельный материал. Ему легко придать нужную форму, из него изготовляют полностью закрытые сосуды. Стекло прочнее кварца, но размягчается при более низкой температуре. Боросиликатные стекла, например пирекс, из которых обычно изготовляют жароустойчивую лабораторную аппаратуру, размягчается уже при температуре 600 оС. Большой недостаток стекла в его значительной загрязненности, некоторые из его примесей переходят в обрабатываемые вещества. Кроме того, при нагревании стекла из него выделяется вода. Боросиликатное стекло, содержащее 96 % двуокиси кремния и почти 4 % окиси бора, называется викором. По своей прочности и теплостойкости оно родственно кварцу, но имеет более низкую температуру размягчения. Из благородных металлов чаще других применяется платина. Ее преимущество в стойкости и механической прочности. Платину можно нагреть на воздухе до 1500 оС без какого-либо разрушения. Она инертна к галогенидам и окислам, но не в восстановительной атмосфере. Платина взаимодействует с большей частью расплавленных металлов, а также с серой, селеном, теллуром, фосфором, мышьяком и сурьмой в расплавленном состоянии. В качестве тигельного материала очень удобен графит. Он инертен ко всем расплавленным металлом, за исключением алюминия, бора, кремния и германия. В отсутствие кислорода он применим вплоть до 2500 оС. Графит очень удобно нагревать индукционно или непосредственно током. Он обладает высокой термостойкостью. Пористость графита зависит от способа производства, однако выпускаемый в настоящее время графит вакуум не удерживает. Окись алюминия (глинозем) используется для нагрева до 1850 оС. Из нее изготавливают вполне вакуумноплотную посуду с очень гладкой поверхностью. По механическим свойствам глинозем уступает кварцу, в частности у него более высокий коэффициент теплового расширения. Чистота сортовой технической окиси алюминия обычно около 99,8 %. Глинозем стоек в отношении металлов и может быть использован в контакте со щелочными металлами. Будучи устойчив по отношению ко всем кислотам, окись алюминия легче взаимодействует с едкими щелочами. С окислами металлов она взаимодействует при температурах выше 800 оС. Глинозем более порист, чем кварц. В настоящее время широко применяются в качестве тигельного материала тугоплавкие окислы: окись бериллия, окись магния, двуокись циркония и двуокись тория. Они выдерживают более высокий нагрев, чем окись алюминия (некоторые из них до 2400 оС). По сравнению с окисью алюминия они обычно более пористы, особенно окись бериллия. По способу приготовления изделий, механических и термических свойств и чистоте все они близки к окиси алюминия. Окись бериллия («сладкозем») чрезвычайно ядовита, поэтому с ней следует обращаться осторожно.
Лекция 2. Выращивание монокристаллов из растворов
1) Введение
Формы роста кристаллов из растворов усложняются ввиду присутствия растворителя, играющего роль примеси. Все методы выращивания монокристаллов из растворов основаны на использовании зависимости концентрации с вещества в растворе от термодинамических параметров, определяющих состояние системы: с = f (p, T, c`) (4.9)
где с` - концентрация «вспомогательных» веществ, которые в случае многокомпонентной системы могут находиться в растворе. Величиной пересыщения можно управлять, изменяя по уравнению (4.9) концентрацию с. Способы задания пересыщения (движущей силы кристаллизации) различны. Если пересыщение создается изменением температуры или испарением растворителя, то такие условия кристаллизации называют нестационарными. Кривые растворимости позволяют сделать выбор целесообразного метода выращивания монокристаллов данного вещества. Поэтому, приступая к выращиванию кристаллов какого-либо вещества, необходимо иметь кривую его растворимости и на ней основывать технические расчеты кристаллизации. Если пересыщение создается тепловой или концентрационной конвекцией раствора, а также вынужденной конвекцией или путем химической реакции в условиях встречной диффузии вещества, то такие условия кристаллизации называются стационарными. Гидротермальный метод представляет собой пример кристаллизации в стационарных условиях. У растворов метастабильная область значительно уже, чем у расплавов; она еще более сужается при хорошем перемешивании растворов. Вероятность возникновения зародышей возрастает, эта возможность зависит и от количества пересыщенного раствора за счет спонтанного образования флуктуациями энтропии. Поэтому большое количество раствора в метастабильном состоянии для выращивания больших монокристаллов можно сохранить при малом пересыщении, которое восполняется по мере надобности непрерывной подачей небольших количеств пересыщенного раствора (подпиткой). Типичными дефектами для кристаллов, полученных из растворов, всегда будут включения маточной среды, но в них ниже плотность дислокаций, угол разориентации блоков не превышает первые единицы минут.
2) Построение кривой растворимости
Под растворимостью принято понимать максимальное количество вещества (предельная концентрация), способное раствориться при данных условиях в определенном количестве растворителя. Растворимость зависит от природы растворителя и растворенного вещества и от термодинамических условий растворения. Способы выражения концентрации – величины, характеризующей количество данного вещества в растворе, - различны. Наиболее распространено и принято в большинстве справочников по растворимости солей выражение в весовых процентах (вес.%), т.е. число граммов растворимого вещества в 100 г раствора. Концентрацию раствора обычно определяют косвенными методами, например измерением удельного веса или показателя преломления раствора. Пересчитав результаты по соответствующим таблицам, далее, по графику или по таблице растворимости находят, при комнатной температуре раствор данной концентрации становится насыщенным. Но такое определение неточно. Для прямого установления температуры насыщения используется явление концентрационных потоков, которое позволяет определить температуру насыщения раствора с точностью иногда до 0,1 оС. Сущность метода концентрационных потоков, предложенного А.Н. Ковалевским, заключается в том, что о состоянии раствора судят по направлению концентрационных потоков, возникающих благодаря изменению плотности среды вокруг кристалла, который помещен в собственный раствор. Нисходящие от кристалла концентрационные потоки указывают на его растворение. Восходящие от кристалла потоки характерны для пересыщенного раствора (метастабильная область), когда кристалл растет. В насыщенном растворе, отвечающем, например, точке Д на кривой растворимости (см. рис. 1.1), устанавливается динамическое равновесие, исключающее концентрационные потоки. Для определения tН раствора данной концентрации нагревают (охлаждают) раствор до ненасыщенного состояния и, далее, поместив в него кристаллик соли, растворимость которой исследуется, медленно охлаждают (нагревают), отмечая температуру t1, при которой исчезают нисходящие потоки растворения кристалла. Продолжая постепенно охлаждать раствор, находят температуру появления потоков роста t2. Среднее арифметическое Для построения кривой растворимости с = f (t) необходимо около десятка точек. Фиксация каждой требует приготовления раствора соответствующей концентрации и, следовательно, для снятия всей кривой растворимости необходимо около десятка порций растворов, которые проще всего получить разбавлением исходного концентрированного раствора. Если m вес.% - отношение веса твердого вещества к весу всего раствора, а – вес всего раствора, b – вес твердого вещества, то х – количество растворителя, нужное для получения разбавленного раствора n вес.%, будет:
3) Технический расчет кристаллизации
Кривая растворимости с = f (t) выбранного вещества и уравнение баланса массы:
лежат в основе технического расчета кристаллизации, предшествующего процессу кристаллизации. В форму (4.10)
где ρ – плотность вещества; λi – нормальная скорость роста i -той грани; Si – ее поверхность; t – время. Вторая равна:
где Имея кривую растворимости, можно рассчитать: 1) необходимое количество растворителя и соли для получения кристалла желаемого веса, если кристаллизация происходит в интервале изменения температур (t2 – t1); 2) вес кристалла, который можно получить из данного объема раствора при изменении температуры от t2 до t1; 3) количество растворенного вещества, переходящего в кристаллическую фазу из данного объема раствора при изменении температуры на доли градуса от заданной.
4) Кристаллизация путем изменения температуры в водных растворах
В этом методе пересыщение достигается путем непрерывного изменения температуры во всем объеме кристаллизатора. Подавляющее большинство веществ характеризуется прямой зависимостью растворимости от температуры. Для них пересыщение создается снижением температуры. Любая кристаллизационная установка, используемая для выращивания кристаллов из водных растворов в динамическом режиме, состоит из следующих основных узлов (рис. 4.4): кристаллизатора с платформой для крепления кристалла – кристаллоносцем, блока питания всей установки и регулирования температуры, мешалки с электрическим приводом. В изображенной установке нагревателем служит безынерционная печь с нихромовой обмоткой, холодильником-помещением, в котором производится кристаллизация. Блок терморегулировки состоит из реле, на которое поступают сигналы от контролирующей температуру контактного термометра. При замыкании и размыкании цепи контактного термометра реле соответственно включает или выключает нагреватель, поддерживая тем самым температуру кристаллизации вблизи заданного уровня. Изменение температуры в процессе роста кристалла производится подвижным контактом терморегулятора. Моторчик с мешалкой обеспечивает необходимое перемешивание раствора. Температура раствора измеряется
обычным термометром. В учебных лабораторных условиях полезно использовать катетометр с вертикальной и горизонтальной шкалами и точностью отсчета по обеим нониусам 0,02 мм. Катетометр позволяет измерять линейные скорости роста кристалла без нарушения режима кристаллизации. Затравкой может служить маленький (3 – 5 мм) ограненный кристаллик того вещества, раствор которого заполняет кристаллизатор. До начала кристаллизации производят микрометрический замер линейных размеров кристаллической затравки и рассчитывают ее активную поверхность и массу. Контролем правильности проведенного расчета служит взвешивание затравки. Затравка приклеивается парафином к платформе и помещается в пустой кристаллизатор. Приготовление насыщенного при задаваемой температуре раствора и определение его точки насыщения производятся в отдельной посуде по правилам, изложенным выше. Для расчета необходимого количества соли, насыщающего раствор, используется кривая растворимости данного вещества. Приготовленный раствор перегревается на несколько градусов выше точки насыщения и после получасовой выдержки осторожно, без разбрызгивания переливается в кристаллизатор, крышка которого, мешалка, контактный и ртутный термометры перед этим пропариваются для устранения возможных случайных центров кристаллизации. На герметической крышке затем устанавливаются термометры. Перемешивание раствора до полной регенерации затравочного кристалла не допускается. Так как кристаллизатор, заполненный раствором, имеет цилиндрическую форму, то следует определить коэффициент искажения линейных размеров растущего кристалла, измеряя катетометром кажущийся диаметр стержня мешалки и относя полученную величину к известному размеру диаметра стержня. За температурой раствора непрерывно ведется наблюдение. Отмечают начало роста кристалла, наблюдая первые признаки регенерации кристаллической затравки (появление «шероховатостей», острых углов и плоских граней не ее поверхности.). Установив начало роста, прекращают понижение температуры, включая терморегулятор. После полной регенерации затравки (восстановление ее первоначальных размеров) соответствующим понижением температуры создают необходимое пересыщение раствора, допускаемое размерами поверхности кристалла и включают мотор перемешивающего механизма со скоростью 60 об / мин. Далее, через каждые 15 – 20 мин измеряют температуру и размеры кристалла. Очередное понижение температуры производят с учетом количества вещества, перешедшего в кристаллическую фазу, когда пересыщение раствора достигает половины от первоначальной величины. Во время работы необходимо вести журнал наблюдений, в котором записываются все данные, относящиеся к подготовке и проведению кристаллизации. Закончив кристаллизацию, вынимают платформу-кристаллоносец из раствора. Неиспользованный раствор переливают в чистый сосуд и герметически закрывают. Кристаллизатор и все детали установки, соприкасающейся с раствором, тщательно промывают теплой водой. Пересыщенный раствор, из которого ведется выращивание, представляет собой неустойчивую систему, в которой велики шансы возникновения добавочных кристаллов-паразитов. Процесс образования их носит иногда лавинообразный характер: при трении их о дно и стенки сосуда и столкновении между собой возникают новые центры кристаллизации. Вредность «паразитов» в том, что, питаясь за счет основного кристалла, они нарушают режим снижения температуры и образуют с основным кристаллом всевозможные сростки. На практике все же можно создать условия, исключающие источники «паразитов». Прежде всего следует предохранить раствор от попадания зародыша извне, для чего на всех стадиях процесса подготовки к кристаллизации и ее проведения необходима полная чистота, а также герметичность загруженного кристаллизатора. Источником «паразитов» может стать сама затравка, вводимая в раствор. Чтобы избежать этого, затравочный кристалл предварительно обрабатывают, обтачивают мокрой тряпочкой неровные участки граней, его углы и ребра. Возникшая в результате такой обработки на поверхности кристалла тонкая кристаллическая пыль удаляется путем кратковременного опускания кристалла в теплую воду. Облегчает образование «паразитов» наличие острых краев и выступов во всех предметах, соприкасающихся с раствором. Во избежание «паразитов» не следует допускать соприкосновения кристалла с предметами, имеющими весьма отличающиеся коэффициенты температурного расширения. Слишком быстрое движение кристалла при высоком пересыщении также приводит к возникновению «паразитов». Этому же всегда способствуют сильная вибрация и местные переохлаждения. В целях исключения источников «паразитов» следует пользоваться чистой солью и дистиллированной водой. Особое внимание уделяется движению раствора и кристалла, необходимому для выравнивания разности пересыщения во весь период роста кристалла. Недаром динамические приемы выращивания кристаллов из растворов получили название скоростных методов выращивания сравнительно однородных кристаллов. Известно, что монокристаллы растут по-разному при разных движениях кристалла или раствора. Поэтому для выращивания многих монокристаллов применяется реверсивное вращательное движение. Впервые Г.В. Вульф пользовался вращающимися кристаллизаторами и приспособлениями с часовым механизмом, которые все время поворачивали кристалл и ставили тем самым различные его грани в одинаковые условия. В.Б. Татарским был впервые предложен способ планетарного движения самого кристалла. На успешный рост кристаллов оказывает влияние также и скорость вращения. Последняя, в свою очередь, определяется формой кристаллоносца, вязкостью и количеством раствора, а также формой и размером вращаемых кристаллов. Очень важна правильно выбранная продолжительность перерыва между сменами направлений вращения оси, во время которой движущийся раствор медленно останавливается. Необходимо, чтобы при повторном разбеге мотора не происходило резких движений.
Хорошие результаты дает способ достаточно быстрого выращивания, главным образом, затравочных кристаллов в статическом режиме. При нагревании приготавливается насыщенный раствор соли, который переливается в предварительно прогретый горячей водой цилиндрический сосуд Дьюара. В горячем растворе подвешивается кристалл. Сосуд плотно закрывают картонной крышкой с глубокими краями и помещают в бочонок или деревянный ящик, наполненный ватой или сухими древесными опилками (рис. 4.5). Чем лучше изолирован сосуд, тем медленнее охлаждение и тем более совершенным вырастает кристалл. Вскрывают ящик через несколько суток, кода температура раствора снизилась до температуры помещения.
5) Кристаллизация посредством испарения растворителя
Если вещество обладает малым к.т.р., то пересыщенные его растворы целесообразно получать путем испарения растворителя при постоянной температуре раствора. Испарение растворителя можно регулировать током сухого воздуха, который проходит над поверхностью раствора, увлажняется и удаляется через отверстие в крышке кристаллизатора. Выращивание кристаллов сернокислого лития Li2SO4 · H2 производится при высокой температуре (95 – 100 оС) из слабокислых растворов (рН 4,5 – 5). При этом используются термостатированные стеклянные кристаллизаторы емкостью около 9 л, схематически изображенные на рис. 4.6. Отвод конденсата осуществляется сифоном. Кристаллы выращивают с подпиткой – по мере слива конденсата добавляется свежий раствор. Для этого кристаллизатор соединяют с сосудом, из которого по принципу сообщающихся сосудов раствор непрерывно поступает в кристаллизатор. Подачу раствора необходимо вести плавно и в количествах, равных количеству сливаемого конденсата. Кристаллоносцем служит вертикальная ось из титана с ввинчивающимися в нее горизонтальными отростками, которая заканчивается цанговыми зажимами для укрепления стержневых затравок. Ось кристаллоносца проходит через укрепленный на крышке кристаллизатора стеклянный шариковый холодильник, служащий для возврата конденсата.
|


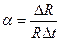 . Для большинства металлов α = 4·10-3 1/град, но на величину α влияют примеси. Желательно, чтобы зависимость сопротивления от температуры выражалась монотонной кривой (лучше - линейной). Металл должен быть химически стойким и сохранять свои характеристики неизменными.
. Для большинства металлов α = 4·10-3 1/град, но на величину α влияют примеси. Желательно, чтобы зависимость сопротивления от температуры выражалась монотонной кривой (лучше - линейной). Металл должен быть химически стойким и сохранять свои характеристики неизменными. представляет собой температуру, в значительной мере приближающуюся к истинной температуре насыщения раствора.
представляет собой температуру, в значительной мере приближающуюся к истинной температуре насыщения раствора.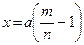 .
. (4.10)
(4.10) - масса вещества, отложившаяся на кристалле; dc – убыль пересыщения раствора. Первая равна:
- масса вещества, отложившаяся на кристалле; dc – убыль пересыщения раствора. Первая равна: ,
,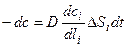 ,
,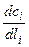 - градиент концентраций у i -той грани; D – коэффициент диффузии; li – расстояние, на которое переместилась грань по нормали.
- градиент концентраций у i -той грани; D – коэффициент диффузии; li – расстояние, на которое переместилась грань по нормали.
 Важнейшее значение в практике выращивания совершенных монокристаллов придается поддержанию и программному понижению температуры. При выращивании высококачественных кристаллов колебания температуры раствора должны быть минимальны. Такое сохранение температуры в данных пределах зависит от чувствительности применяемых регулировочных элементов, количества раствора и общего устройства кристаллизатора. Задача поддержания и программного понижения температуры успешно решается путем использования термостатов, куда помещаются кристаллизаторы с раствором и контактные термометры. Устройство и размер термостатов бывают самые разнообразные. Для заводского выращивания кристаллов сегнетовой соли применяется большой воздушный термостат – комната, вмещающая до нескольких десятков кристаллизаторов. Нагрев осуществляется сопротивлениями, расположенными в полу термостата. Температура регулируется автоматически системой контактных магнитных термометров. Движения руководящих магнитов контактных термометров управляются электронным импульсным датчиком при помощи шагового механизма. Этим путем достигается равномерное падение температуры на десятые доли градуса в сутки.
Важнейшее значение в практике выращивания совершенных монокристаллов придается поддержанию и программному понижению температуры. При выращивании высококачественных кристаллов колебания температуры раствора должны быть минимальны. Такое сохранение температуры в данных пределах зависит от чувствительности применяемых регулировочных элементов, количества раствора и общего устройства кристаллизатора. Задача поддержания и программного понижения температуры успешно решается путем использования термостатов, куда помещаются кристаллизаторы с раствором и контактные термометры. Устройство и размер термостатов бывают самые разнообразные. Для заводского выращивания кристаллов сегнетовой соли применяется большой воздушный термостат – комната, вмещающая до нескольких десятков кристаллизаторов. Нагрев осуществляется сопротивлениями, расположенными в полу термостата. Температура регулируется автоматически системой контактных магнитных термометров. Движения руководящих магнитов контактных термометров управляются электронным импульсным датчиком при помощи шагового механизма. Этим путем достигается равномерное падение температуры на десятые доли градуса в сутки.


