c.( №1578) – пример № 3 с.13,14.
Последней задачей в практикуме химических методов анализа является иодометрическое определение меди в растворах, которое основано на реакции, рассмотренной в предыдущей лекции:
Иод, выделившийся в количестве, эквивалентном количеству меди, оттитровывают стандартным раствором тиосульфата в присутствии крахмала в качестве индикатора. КТТ определяют по обесцвечиванию раствора иодкрахмального комплекса.
При этом Ион водорода не принимает участия в реакции, однако значение pH влияет на скорость процесса, а также на правильность определения из ‑ за возможных побочных процессов гидролиза (образования гидроксокомплексов меди при pH > 4) и инду–цированного окисления иодида калия кислородом воздуха (при [H+] > 0,3 моль·л–1). Источником существенной отрицательной ошибки результатов титрования является адсорбция иода (корректнее – трииодид ‑ иона) осадком CuI. Трииодид ‑ ион настолько прочно удерживается поверхностью осадка, что реакция между тиосульфатом и трииодидом (иодом) не проходит до конца. Это можно избежать, если в раствор при приближении КТТ добавить небольшой избыток тиоцианата калия. При этом на поверхности выпавшего осадка будет протекать реакция обмена:
За счет меньшей растворимости осадка Cu(SCN), он практически не адсорбирует трииодид ион. Однако тиоцианат нельзя добавлять в раствор в начале титрования, так как трииодид ион медленно окисляет его. Иодометрическое определение кислот см. Калинкин И.П. Титриметрические методы анализа. Примеры решения задач. Учебное пособие:[Текст] / И.П. Калинкин, Т.Э. Маметнабиев - СПб.: СПбГТИ (ТУ), 2009. – 43 c.(№1578) –Раздел 2.7 с. 36, 37. Дихроматометрия (хроматометрия, бихроматометрия). В основе дихроматометрии лежат реакции окисления дихроматом калия в кислой среде:
Сопоставление величин стандартных окислительно – восстановительных потенциалов перманганата калия и дихромата калия показывает, что последний является менее сильным окислителем и поэтому он менее широко применяется. В отличие от перманганатометрии титрования можно проводить в солянокислой среде. При этом Cl─ ионы не окисляются, т.к. Стандартный раствор K2Cr2O7 готовят по точной навеске поскольку препарат отвечает всем требованиям, предъявляемым к первичным стандартам. Наиболее важным практическим применением дихроматометрии является определение железа в рудах, шлаках, сплавах, сталях и т.д., которое, после растворения анализируемых объектов, восстанавливают до Fe2+ (как и в перманганатометрии) и титруют стандартным раствором K2Cr2O7. В ТЭ
Реакция титрования железа(II) является заключительным этапом различных аналитических методик, основанных на реакциях взаимодействия Fe(III) или Fe(II) с определяемым веществом. Например, хром в сталях окисляют до Cr2O72─, добавляют избыток стандартного раствора соли Мора Индикатором обычно служит дифениламин (см. табл.); титрование Fe2+ необходимо проводить в присутствии H3PO4, связывающей образующиеся при реакции Fe3+ ─ ионы в бесцветный комплекс Броматометрия см. Калинкин И.П. Титриметрические методы анализа. Примеры решения задач. Учебное пособие:[Текст] / И.П. Калинкин, Т.Э. Маметнабиев - СПб.: СПбГТИ (ТУ), 2009. – 43 c.(№1578) – примеры №№ 45, 46 с. 37, 38.
Примеры расчетов при стандартизации растворов, и см. Калинкин И.П. Титриметрические методы анализа. Примеры решения задач. Учебное пособие:[Текст] / И.П. Калинкин, Т.Э. Маметнабиев - СПб.: СПбГТИ (ТУ), 2009. – 43 c.(№1578) – с.20 – 22.
|



 ,
, 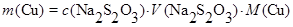


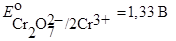
 практически равен потенциалу пары
практически равен потенциалу пары  . Однако при концентрациях HCl больше, чем 2 моль∙л─1, а также при кипячении бихромат окисляет Cl─ ионы до Cl2
. Однако при концентрациях HCl больше, чем 2 моль∙л─1, а также при кипячении бихромат окисляет Cl─ ионы до Cl2 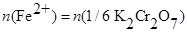 откуда масса
откуда масса  (в г):
(в г):  или
или  ,
,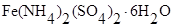 и остаток соли оттитровывают стандартным раствором дихромата калия (способ обратного титрования).
и остаток соли оттитровывают стандартным раствором дихромата калия (способ обратного титрования). и тем самым понижающей окислительно – восстановительный потенциал этой редокс – пары. Только в этом случае изменение окраски индикатора происходит в пределах скачка потенциала на кривой титрования.
и тем самым понижающей окислительно – восстановительный потенциал этой редокс – пары. Только в этом случае изменение окраски индикатора происходит в пределах скачка потенциала на кривой титрования.


