АДСОРБЦИЯ УКСУСНОЙ КИСЛОТЫ НА ПОВЕРХНОСТИ АКТИВИРОВАННОГО УГЛЯ
Свойства участка фазы, примыкающего к поверхности раздела фаз, отличаются от свойств фазы в объеме: фактически частицы, находящиеся на поверхности каждой фазы, образуют особую поверхностную фазу, свойства которой существенно отличаются от свойств внутренних областей фазы. Частицы, расположенные на поверхности, находятся в другом окружении по сравнению с частицами, находящимися в объеме фазы, те взаимодействуют как с однородными частицами, так и с частицами другого рода. Следствием этого является то, что средняя энергия частицы, находящейся на поверхности раздела фаз отличается от средней энергии такой же частицы в объеме фазы (причем энергия частицы на поверхности может быть как больше, так и меньше энергии частицы в объеме). Поэтому важнейшей характеристикой поверхностной фазы является поверхностная энергия Gs. Для характеристики поверхности раздела, отделяющей одну фазу от другой, вводится понятие поверхностное натяжение σ; – отношение поверхностной энергии к площади поверхности раздела фаз; величина поверхностного натяжения зависит только от природы обеих фаз. Как и поверхностная энергия фазы поверхностное натяжение может иметь как положительное, так и отрицательное значение Поверхностное натяжение положительно, если находящиеся на поверхности частицы взаимодействуют с частицами этой же фазы сильнее, чем с частицами другой фазы. Согласно принципу минимума свободной энергии, любая фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию; поэтому в случае положительного поверхностного натяжения фаза стремится уменьшить свою поверхность. На границе конденсированной (т.е. твердой или жидкой) фазы с газом поверхностное натяжение всегда положительно, поскольку частицы конденсированной фазы взаимодействуют друг с другом сильнее, чем с молекулами газа. Согласно принципу минимума свободной энергии, конденсированная фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию. Это может быть результатом либо уменьшения площади поверхности фазы (именно поэтому капля жидкости в невесомости принимает форму сферы), либо уменьшения поверхностного натяжения при появлении на поверхности раздела фаз новых частиц – молекул газа либо растворенного вещества. Процесс Явление самопроизвольного изменения концентрации какого-либо вещества у поверхности раздела двух фаз называется абсорбцией. Повышение концентрации газообразного или растворенного вещества на поверхности раздела фаз, например, на поверхности раздела твердое тело – газ, твердое тело – раствор, жидкость – газ (воздух) называется адсорбцией. Газ или растворенное вещество, концентрирующееся на поверхности, называется адсорбтивом, а вещество, на поверхности которого происходит адсорбция – адсорбентом. Различают физическую адсорбцию, когда частицы адсорбированного вещества не образуют химических связей с адсорбентом, и хемосорбцию, когда адсорбционные силы имеют химическую природу. Адсорбция определяется природой поглощаемого вещества и поглотителя, ее величина зависит от температуры, давления поглощаемого газа, концентрации раствора, из которого осуществляется адсорбция. Количество адсорбированного вещества пропорционально площади поверхности тела. Поэтому вещества в мелкораздробленном состоянии, имея большую поверхность, обладают значительной адсорбционной способностью. К эффективным адсорбентам можно отнести уголь, силикагель, глину, каолин, а также целлюлозу, фильтровальную бумагу, хлопчатобумажную ткань, натуральный шелк, шерсть и другие материалы. Зависимость адсорбции от давления газа (его концентрации) или содержания адсорбируемого вещества в растворе при данной температуре может выражаться уравнением адсорбции Лэнгмюра (изотермой Лэнгмюра)
где Г и Г¥ – количества адсорбированного вещества на единице поверхности адсорбента, выражаются в моль/м2, Г – адсорбция в состоянии адсорбционного равновесия, Г¥ – максимально возможная адсорбция; С – концентрация (моль/л) адсорбируемого вещества в растворе в состоянии адсорбционного равновесия (равновесная концентрация); К – константа Лэнгмюра.
Для экспериментального определения Г¥ и К уравнение адсорбции Ленгмюра преобразовывают и приводят к виду прямопропорциональной зависимости у=кх+а:
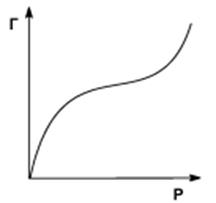
Теория полимолекулярной адсорбции Поляни На практике часто (особенно при адсорбции паров) встречаются так называемые S-обраэные изотермы адсорбции (рис. 3). Форма кривой адсорбции свидетельствует о возможном взаимодействии адсорбированных молекул с адсорбатом.
Для описания таких изотерм адсорбции М. Поляни предложил теорию полимолекулярной адсорбции, основанную на следующих основных положениях 1 Адсорбция вызвана чисто физическими силами 2 Поверхность адсорбента однородна, те на ней нет активных центров: адсорбционные силы образуют непрерывное силовое поле вблизи поверхности адсорбента 3 Адсорбционные силы действуют на расстоянии, большем размера молекулы адсорбата Иначе говоря, у поверхности адсорбента существует некоторый адсорбционный объем, который при адсорбции заполняется молекулами адсорбата. 4 притяжение молекулы адсорбата поверхностью адсорбента не зависит от наличия в адсорбционном объеме других молекул, вследствие чего возможна полимолекулярная адсорбция. 5 Адсорбционные силы не зависят от температуры и, следовательно, с изменением температуры адсорбционный объем не меняется.
Уравнение Фрейндлиха В некотором интервале концентраций, для не слишком разбавленных, но и не очень концентрированных растворов, адсорбция может быть описана эмпирическим уравнением Фрейндлиха:
где х - количество растворенного вещества, адсорбированного массой m поглотителя и находящегося в равновесии с раствором концентрации С, а и n - эмпирические константы, характерные для данного процесса адсорбции в определенных пределах, n характеризует кривизну изотермы адсорбции (рис. 4), обычно имеет значения от 0,1 до 0,6.
Строго говоря, количество адсорбированного вещества следует относить не к единице массы, а к единице площади поверхности, но для мелкораздробленных веществ и однородных суспензий (например, взмученный порошок активированного угля) поверхность растет пропорционально обшей массе. Для нахождения значений эмпирических констант а и n по экспериментальным данным нужно прологарифмировать уравнение (3), тогда оно примет вид:
Полученное уравнение есть уравнение прямой линии (рис. 5). По оси ординат откладывают величины lg(x/m), а по оси абцисс – Ig C. Прямая отсекает на оси ординат отрезок, равный lg a, a n – это тангенс угла наклона полученной прямой. Если адсорбция какого-либо вещества данным адсорбентом значительно превосходит адсорбцию других, то говорят об избирательной адсорбции. На явлении избирательной адсорбции основан хроматографический метод анализа Н.С.Цвета.
|

 (1),
(1),


 (2)
Рис. 2. Линейный вид изотермы адсорбции Ленгмюра.
Тангенс угла наклона полученной прямой:
(2)
Рис. 2. Линейный вид изотермы адсорбции Ленгмюра.
Тангенс угла наклона полученной прямой:  , прямая отсекает на оси ординат отрезок, равный
, прямая отсекает на оси ординат отрезок, равный 
 (3),
(3),

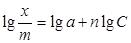 (4).
(4).


