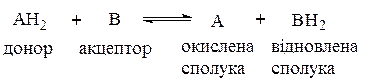Вплив рН середовища.
Ферменти, як і інші білки, — амфотерні сполуки, тому їх активність в значній мірі залежить від рН середовища. Значна частина ферментів найбільш активна в середовищі, близькому до нейтрального. Значення рН, при якому фермент проявляє максимальну активність, називається рН-оптимумом. Активність ферменту залежить від рН середовища внаслідок присутності: — тих чи інших іонізуючих груп активного центру ферменту, які зв'язують субстрат; — функціональних груп молекули субстрату, що беруть участь у зв'язуванні субстрату з ферментом; — функціональних груп молекули ферменту, що відповідають за каталітичний акт. Деякі ферменти мають рН-оптимум в дуже кислому або лужному середовищі.
Таблиця 5. – рН-оптимум дії деяких ферментів організму людини
5. Оборотність дії ферментів. Ферменти, як каталізатори білкової природи, можуть прискорювати хімічні реакції, як в прямому, так і в оборотному напрямку. Наприклад, фермент ліпаза прискорює як реакцію гідролізу жирів, так і реакцію їх синтезу. 6. Вплив активаторів та інгібіторів на дію ферментів. Речовини, що підвищують активність ферментів та збільшують швидкість ферментативних реакцій, називаються активаторами. Таким чином, активатори це каталізатори ферментативних реакцій. До специфічних активаторів ферментів належать катіони одно- та полівалентних металів: K+, Na+, Rb+, Cs+, Ca2+, Zn2+, Cd2+, Cu2+, Mn2+, Fe2+, Co2+, Ni2+, Cu3+, Al3+, а також катіон NH4+, який активує декілька ферментів. Особливо часто активаторами ферментів бувають іони Mg2+, Zn2+, K+, Co2+, а з аніонів — Cl–. Однак, треба мати на увазі, що дія аніонів значно менша, ніж катіонів. Механізм впливу іонів металів-активаторів на ферменти. 1. Метал може входити до складу активного центру ферменту (Co2+, Fe2+, Mn2+, Zn2+ та інші). 2. Може бути зв'язуючою часткою між ферментом та субстратом. 3. Сприяє приєднанню коферменту до апоферменту. 4. Забезпечує становлення четвертинної структури ферменту, від якої залежить його каталітична активність. 5. Може змінювати константу рівноваги ферментативної реакції. 6. Може приєднуватися до алостеричного центра ферменту та змінювати його третинну та четвертинну структуру, в результаті чого субстратний та каталітичний центри ферменту набувають найбільш корисну для здійснення своїх функцій конфігурацію. Активаторами ферментів, поряд з катіонами металів може бути аніон Cl— який є активатором a - амілази тваринного походження; a - амілаза, яка міститься у слині, активується аніонами Cl— харчової солі їжі. Активатори ліпази — солі жовчних кислот. Інгібітори — це сполуки, що гальмують дію ферментів та зменшують швидкість ферментативних реакцій. Механізми гальмуючої дії ферментів різні, але у більшості випадків зводяться до двох типів інгібірування: конкурентного та неконкурентного. Під час конкурентного гальмування інгібітор, що має структурну схожість із субстратом, з’єднується з ферментом, замінюючи собою субстрат, що конкурує з ним. Під час неконкурентного гальмування інгібітор взаємодіє з апоферментом або простетичною групою, внаслідок чого фермент втрачає активність. Одним з прикладів неконкурентного гальмування є блокування ферментів важкими металами, солями синільної кислоти.
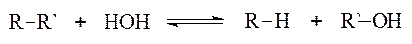
III.4. Класифікація ферментів. Сучасна класифікація ферментів спирається на найважливіші типи біохімічних реакцій. За цією системою класифікації, що прийнята у 1961 році V міжнародним біохімічним конгресом у Москві, всі відомі ферменти (≈ 2000) підрозділяються на 6 типів: 1. Лігази (синтетази) — це ферменти синтезу. Вони каталізують реакції сполучення двох молекул, використовуючи енергію АТФ, або аналогічних нуклеозидтрифосфатів. 2. Гідролази — це ферменти гідролітичної дії. Вони каталізують реакції гідролізу, тобто розщеплення сполуки за допомогою води:
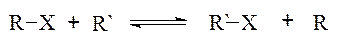
3. Трансферази — це ферменти транспортної дії. Вони каталізують перенесення різних груп, радикалів, залишків та окремих молекул:
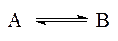
4. Ліази — це ферменти, які каталізують реакції негідролітичного відщеплення від органічних сполук простих молекул (H2O, CO2, H2S, NH3, та ін.) з утворенням в молекулах субстрату кратних зв’язків або приєднання цих простих молекул за подвійними зв’язками. 5. Ізомерази — ферменти, які каталізуть реакції ізомерізації (ізомерії):
6. Оксидоредуктази, або окисно-відновні ферменти. В загальному вигляді вони каталізують реакції:
Кожний клас поділяється на підкласи, а підклас на підпідкласи.
|