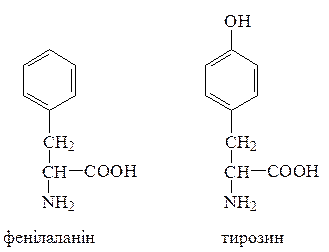Т.В. Нужна, Ю.О. Лесишина
БІОЛОГІЧНА ХІМІЯ Методичні рекомендації для самостійного вивчення курсу та виконання контрольних і лабораторних робіт для студентів факультету ресторанно-готельного бізнесу напряму підготовки «Харчові технології та інженерія» заочної форми навчання
Затверджено на засіданні кафедри хімії Протокол № _ _ від______ 2013р.
Схвалено навчально-методичною радою ДонНУЕТ Протокол №____від _________ 2013р.
ДонНУЕТ Донецьк
УДК 577.1 (076.5) ББК 28.072 я 73 Н 88
Рецензенти: Ю А. Горяйнова – канд. техн. наук, доц.; М.В. Савоськін –канд. хім. наук, старший науковий співробітник відділу супрамолекулярної хімії ІНФОВ НАНУ ім. Л.М. Литвиненка Нужна Т.В. Н 88 Біологічна хімія: метод. рек. для самост. вивч. курсу та викон. контр. і лаб. робіт для студ. ФРГБ напряму підготов. «Харчові технології та інженерія» заоч. форми навчання / Т.В. Нужна, Ю.О. Лесишина. – Донецьк: ДонНУЕТ, 2013. – 55с.
Навчальне видання призначене для самостійного вивчення курсу та виконання контрольних і лабораторних робіт з дисципліни «Біологічна хімія» студентами факультету ресторанно-готельного бізнесу, які навчаються за напрямом підготовки «Харчові технології та інженерія» заочної форми навчання. У методичних рекомендаціях наведений теоретичний матеріал для самостійної роботи студентів, 7 лабораторних робіт, завдання для виконання контрольної роботи, що охоплюють основні розділи статичної і динамічної біохімії, перелік літератури, що рекомендується.
УДК 577.1(076.5) ББК 28.072 я 73
© Нужна Т.В., Лесишина Ю.О., 2013 © Донецький національний університет економіки і торгівлі імені Михайла Туган-Барановського, 2013
ВСТУП
Курс "Біологічна хімія" відноситься до циклу фундаментальних дисциплін, що рекомендуються для вивчення студентам, які навчаються за напрямом підготовки «Харчові технології та інженерія» денної і заочної форми навчання. Для підготовки високо кваліфікованих інженерів-технологів харчування необхідні знання процесів, що здійснюються у тваринних і рослинних організмах – сировині для виробництва харчових продуктів. Тому, метою вивчення курсу "Біологічна хімія" є оволодіння студентами сучасними науковими знаннями про хімічний склад живих тваринних і рослинних організмів, хімічні перетворення їх складових в процесі життєдіяльності, а також роль ферментів, вітамінів, гормонів та інших біологічно активних речовин у цих процесах. Ці знання є також необхідними для розуміння процесів, що протікають під час переробки і зберігання харчової сировини; для організації науково обґрунтованого раціонального харчування, що забезпечує потреби різних груп населення в пластичних та енергетичних речовинах. Крім того, оволодіння біохімічними знаннями є основою для вивчення таких дисциплін, як фізіологія харчування, гігієна та санітарія, теоретичні основи харчових технологій та ін. Кожний студент заочного відділення під час вивчення курсу «Біологічна хімія» повинен у відповідності до робочої програми та календарного плану дисципліни виконати лабораторний практикум, що складається з 7 робіт, підготувати в окремому зошиті контрольну роботу і захистити її. Контрольна робота містить чотири завдання. Номер першого і другого завдання вибирається згідно з першими двома літерами прізвища студента, номер третього завдання – за першою літерою імені, четвертого – за першою літерою по батькові (дивись таблицю 1). Контрольна робота, що виконана не за відповідним завданням, до захисту не приймається. Відповідати на завдання контрольної роботи слід конкретно, з підтвердженням теоретичних положень прикладами біохімічних реакцій. У кінці роботи належить навести список використаної літератури, поставити дату і особистий підпис. НОМЕРА ЗАВДАНЬ ДЛЯ ВИКОНАННЯ КОНТРОЛЬНОЇ РОБОТИ
Таблиця 1.
ТЕОРЕТИЧНИЙ МАТЕРІАЛ ДЛЯ САМОСТІЙНОЇ РОБОТИ СТУДЕНТІВ ТА ВИКОНАННЯ ЛАБОРАТОРНОГО ПРАКТИКУМУ І. БІЛКИ I.1. Визначення та елементарний склад білків. За хімічною природою білки є гетерополімерами, побудованими з залишків a,L -амінокислот, пов'язаних один з одним пептидним зв'язком. Білки – органічні сполуки, які мають такий елементарний склад: Карбон - 51-55%; Оксисен - 21-23%; Гідроген - 6,6-7,3%; Нітроген - 15-18%; Сульфур - 0,3-2,4%. До складу деяких білків входять Фосфор (0,2-2%), Ферум, Кальцій і багато інших елементів. У всіх білках організмів міститься в середньому 16% Нітрогену. Він у білках відносно постійний і визначити його нескладно. Тому за відношенням Нітрогену в білках (100:16 = 6,25) визначають вміст білків у організмі. В основі білкової молекули лежить поліпептид. Постійно в складі білків зустрічається 20 амінокислот, крім цього є амінокислоти, що зустрічаються рідко. Якщо до складу поліпептиду входять менше ніж 40 залишків амінокислот, то це ще не білок, а тільки поліпептид; якщо більше - то це вже молекула, що має властивості білка. I.2. Біологічні функції амінокислот, пептидів і білків. Амінокислоти мають велике біологічне значення: 1. Входять до складу білків рослинних та тваринних організмів. 2. Входять до складу пептидів. 3. З амінокислот в організмі утворено багато низькомолекулярних біологічно активних сполук (γ-аміномасляна кислота, біогенні аміни та ін.) 4. Частина гормонів у організмі – це похідні амінокислот (гормони щитовидної залози, адреналін). 5. Деякі амінокислоти – попередники основ, що входять до складу нуклеїнових кислот. 6. Існують амінокислоти – попередники порфіринів, що необхідні для біосинтезу гему (для гемоглобіну та міоглобіну). 7. Приймають участь у біосинтезі медіаторів нервової системи. Поліпептиди теж мають велике біологічне значення. Серед них зустрічаються пептидні антибіотики; токсини: ботулін – смертельна доза 1·10–11 на 1 кг маси, дифтерійної палички; блідної поганки; зміїної отрути. Усі вони блокують біохімічні реакції організму. З африканських рослин одержані пептиди, що у 22 тис. раз більш солодкі ніж сахароза. Існують пептиди, що викликають сон. Опіумні пептиди енкефалін та ендорфін мають болезаспокійливу дію і викликають ейфорію. Гормони білкової природи -вазопресин і окситоцин - викликають скорочення гладенької мускулатури, тому їх використовують при стимуляції пологів, вони регулюють водний обмін і розщеплення глікогену печінки.
Біологічні функції білків. 1. Ферментативна. У клітині в біохімічних реакціях приймають участь більш 2000 ферментів, при цьому всі вони мають білкову природу. 2. Пластична (структурна). Білки приймають участь у формуванні всіх клітинних структур. 3. Гормональна. В організмі людини 50% всіх гормонів мають білкову природу. 4. Захисна. У крові організму є захисні білки (антитіла). При влученні в кров чужорідних агентів мікроорганізмів, вірусів (антигенів) антитіла входять у комплекс з антигенами людини і виводять їх з ладу. 5. Транспортна. Перенос О2, вищих жирних карбонових кислот (ВЖК), ліпідів, стероїдів, вітамінів, лікарських речовин здійснюється різними фракціями білків крові. 6. Енергетична. При переварюванні (розщепленні) білків виділяється енергія (1 гр. білка – 4,1 ккал). 7. Буферна або гомеостатична. Білки завдяки своїм властивостям підтримують гомеостаз (сталість) організму. 8. Рецепторна. Існують білки – рецептори, завдяки яким ми бачимо, почуваємо, сприймаємо дотиком і т.д. Зважаючи на все це, білки були названі протеїнами (від грец. protos – первинний, найважливіший), тобто найважливішими, найпершими сполуками, що забезпечують прояви життя. Це стосується всіх організмів на Землі. I.3. Хімічна та біологічна класифікація амінокислот, що надходять до складу природних білків. Для вивчення амінокислотного складу білків спочатку проводять їх гідроліз (кислотний, лужний або ферментативний). Кислотний гідроліз білка здійснюють за допомогою розчину хлоридної кислоти (6 моль/л) у запаяній ампулі, з якої попередньо відкачують повітря, при температурі 110ºС протягом 20-72 годин. Одержаний гідролізат містить амінокислоти у вигляді гідрогенхлоридів. Під час кислотного гідролізу, як правило, руйнуються триптофан, амідні групи глутаміну та аспарагіну. Тому для більш ретельного вивчення амінокислотного складу білків додатково здійснюють лужний гідроліз (білок інкубують у розчині NaOH (2-4 моль/л) при температурі 110ºС протягом 3-9 год). У лужному середовищі руйнуються цистеїн, серин, треонін, однак зберігається триптофан. Таким чином, кислотний і лужний гідроліз доповнюють один одного. Конкретні ферменти-протеїнази розривають певні пептидні зв’язки, що полегшує визначення послідовності амінокислот у білках. Для якісного визначення амінокислот у гідролізаті проводять кольорові реакції: ксантопротеїнову – на амінокислоти, що вміщують бензеновий радикал; реакцію Фоля – на сіркувмісні амінокислоти, реакцію Адамкевича – на триптофан. Для кількісного розділення та визначення відносного складу кожної амінокислоти в гідролізаті білків використовують різні методи розподільної та іоннообмінної хроматографії, електрофорезу. Особливо цінні з них автоматизовані. За допомогою аналізатора можна за кілька годин здійснити детальний кількісний та якісний аналіз гідролізату будь-якого білка. Амінокислоти – амфотерні електроліти, оскільки аміногрупа має основні властивості, а карбоксильна – кислотні. У водних розчинах у інтервалі рН від 4 до 9 амінокислоти існують переважно у вигляді біполярних іонів, які називаються цвіттер-іонами або амфі-іонами:
У кислому середовищі карбоксил нейтралізується, тому амінокислота реагує як катіон.
У лужному середовищі біполярний іон втрачає протон, тому амінокислота реагує як аніон:
Якщо рН є нейтральним, карбоксильні групи амінокислот повністю дисоційовані. У біохімічній номенклатурі такі амінокислоти позначають використанням закінчення –ат, наприклад глутамінова кислота – глутамат. Залежно від полярності R-груп амінокислоти поділяються на чотири основні класи: неполярні, або гідрофобні (аланін, лейцин, ізолейцин, валін, пролін, фенілаланін, триптофан, метіонин); полярні, але незаряджені (гліцин, серин, треонін, цистеїн, тирозин, аспарагін, глутамін); позитивно заряджені (лізин, аргінін, гістидин); негативно заряджені (аспарагінова та глутамінова кислоти). Всі амінокислоти, що входять до складу білків, за структурою радикалів (хімічна класифікація амінокислот) поділяються на 8 класів:
1. Амінокислоти з вуглеводневими радикалами
Радикали цих амінокислот гідрофобні, у будь-якому середовищі мають нульовий заряд.
2. Кислі амінокислоти та їхні аміди
Радикали аспарагінової та глутамінової кислот містять карбоксильну групу, яка внаслідок дисоціації у нейтральному і лужному середовищах дає заряд –1.
Радикали аспарагіну і глутаміну полярні, але незаряджені.
3. Окси- (гідрокси) амінокислоти
Радикали цих амінокислот полярні, але недостатньо заряджені, тому прийнято вважати, що у всіх середовищах вони мають нульовий заряд.
4. Основні амінокислоти
Радикали цих амінокислот у нейтральному і кислому середовищі мають заряд +1, внаслідок приєднання до них Н+ (↓ - центр основності).
5. Ароматичні амінокислоти
Радикали цих амінокислот у будь-якому середовищі мають нульовий заряд.
6. Гетероциклічні амінокислоти
Радикали цих амінокислот у будь-якому середовищі мають нульовий заряд. 7. Сульфурвмісні амінокислоти
Радикали цистеїну і метіоніну полярні, але незаряджені. Радикал цистину в нейтральному середовищі має нульовий заряд, у кислому – заряд +1, а в лужному – заряд –1.
8. Гетероциклічні імінокислоти
Радикал проліну та гідроксипроліну у будь-якому середовищі має нульовий заряд. Відповідно до біологічної класифікації амінокислоти поділяються на замінні і незамінні. Незамінні – це ті амінокислоти, які не можуть бути синтезовані в організмі людини, а тому обов'язково повинні міститись в продуктах харчування. До незамінних амінокислот належать: валін, лейцин, ізолейцин, триптофан, метіонін, фенілаланін, треонін, лізин. У дитячому організмі не синтезуються також аргінін і гістидин. Біологічна цінність білків визначається вмістом у їх складі незамінних амінокислот. Так, яєчний альбумін та казеїн молока - це повноцінні білки, тому що вміщують всі незамінні амінокислоти. Колаген та зеїн кукурудзи – неповноцінні білки, тому що не вміщують деякі незамінні амінокислоти, наприклад, лізин. Замінні амінокислоти при необхідності можуть бути синтезовані в організмі людини. I.4. Структура білків.
Прийнято виділяти 4 рівні організації білкової молекули: первинна, вторинна, третинна і четвертинна. Первинна структура - це якісний та кількісний склад амінокислот, послідовність їх розташування в поліпептидних ланцюгах білкової молекули. Основу первинної структури складають пептидні зв’язки. Вперше цю гіпотезу висловив у 1888 році А.Я. Данілевський. Згодом її було підтверджено синтезом пептидів, який здійснив Є. Фішер. На основі гіпотези А.Я. Данілевського Є.Фішер вперше висунув поліпептидну теорію молекули білка. Згідно з цією теорією молекули білка складаються з великої кількості амінокислотних залишків, з’єднаних між собою пептидними зв’язками. Молекула білка може мати один або декілька поліпептидних ланцюгів. Наприклад, молекула ферменту рибонуклеази містить один поліпептидний ланцюг із 124 амінокислотних залишків. Гормон інсулін складається з двох поліпептидних ланцюгів, з’єднаних дисульфідними містками між залишками цистеїну. Вторинна структура – це просторова конфігурація поліпептидного ланцюга. Розділяють три типи вторинної структури: a-спіраль, b-складчаста та колагенова спіраль. На основі рентгеноструктурних досліджень Л. Полінг і Р. Корі встановили, що для структури пептидів найбільш характерною є a-спіраль. a-спіраль – це поліпептидний ланцюг у вигляді правозакрученої спіралі, що фіксується водневими зв'язками, утвореними між СО-групою пептидного зв`язку одного фрагмента і NH-групою іншого. На кожний виток a-спіралі припадає 3,6 амінокислотного залишку. Такий тип вторинної структури характерний для глобулярних білків. Фібрилярні білки a-кератини (шерсть, шкіра, пір’я) складаються з кількох поліпептидних ланцюгів, які мають праву a-спіральну конфігурацію й утворюють міцні суперспіралі, що виконують механічні функції. b-складчаста вторинна структура – це один або декілька паралельних та антипаралельно розміщених поліпептидних фрагментів, які з'єднуються водневими зв'язками, що розташовані перпендикулярно осі поліпептиду. Такий тип структури найчастіше зустрічається у фібрилярних білках (b-кератин, фіброїн та ін.). Зокрема b-кератин має паралельне розташування поліпептидних ланцюгів, які додатково стабілізуються міжланцюговими -S-S- зв’язками. У фіброїні шовку сусідні поліпептидні ланцюги антипаралельні. Колагенова спіраль – це три поліпептиди, оповитих друг щодо друга. Колагенова спіраль стабілізується водневими зв’язками, що виникають між воднем NН-груп залишків амінокислоти одного ланцюга та киснем СО-груп амінокислотних залишків другого. Такий тип характерний тільки для колагену і забезпечує йому пружність, еластичність. Третинна структура – це тривимірна конфігурація поліпептидного ланцюга у просторі. У стабілізації третинної структури білка беруть участь ковалентні і нековалентні зв'язки. Ковалентні зв'язки (–S-S–) між залишками цистеїну. Нековалентні зв'язки: а) гідрофобні взаємодії між радикалами амінокислот, що бояться води; вони виштовхуються в суху зону, цей фактор формує структуру; б) електростатичні взаємодії між зарядженими радикалами; в) водневі зв'язки між деякими радикалами амінокислот. Четвертинна структура – це характерний спосіб об’єднання та розташування у просторі окремих поліпептидних ланцюгів, з яких складається одна функціонально індивідуальна молекула. Великі білкові молекули складаються з декількох складових частин (субодиниць), що іноді називаються протомерами, а саму велику молекулу називають мультимер. Наявність строго визначеної кількості субодиниць та їх взаємне розташування у просторі визначає четвертинну структуру. Для четвертинної структури одних білків характерне глобулярне розташування субодиниць (білок крові гемоглобін). Інші білки об’єднуються в спіральні четвертинні структури за типом гвинтової симетрії (вірус тютюнової мозаїки). Таким чином, є чотири рівні організації білкової молекули. Всі вони взаємозв’язані; послідовність залишків амінокислот, або первинна структура, повністю визначає конформацію білкової молекули. Прояв біологічної активності білків залежить від вищих рівнів їх структурної організації. I.5. Властивості білків. 1. Методи виділення та очищення білків. Для вивчення фізико-хімічних і біологічних властивостей індивідуальних білків їх одержують у чистому вигляді. Спочатку білки екстрагують із клітин або тканин у розчиненному стані, а потім очищають. Для цього використовують різні фізико-хімічні методи. Зазвичай на першому етапі здійснюють ізоелектричне осадження, а потім фракційне осадження білків розчинами нейтральних солей (амонійгідрогенсульфіту, натрій хлоріду та ін.) або спиртом (метиловим, етиловим) з поступовим підвищенням концентрації при низькій температурі (-5...-10ºС). Для подальшого очищення білків останнім часом широко використовується іонообмінна, адсорбційна або афінна хроматографія з різними адсорбентами, а також гельфільтрація на колонках з агаразою, сефадексом, біогелем тощо. Суміш білків можна розділити за допомогою електрофорезу на різних носіях (фільтрувальний папір, поліакриламідний або крохмальний гель та ін.). Основними тестами для визначення гомогенності одержаного білка є стабільний амінокислотний склад, певна молекулярна маса. Гомогенний білок під час електрофорезу переміщується у вигляді однієї смуги й постійно виявляє специфічну біологічну активність (ферментативну, гормональну тощо).
|