Структура белка
a) C2H5OH b) C2H5O- c) H2O d)H3O+ 2. Какое из перечисленных соединений обладает наименьшей кислотностью: a) уксусная кислота b) п-нитробензиловый спирт c) п-нитрофенол d) ацетилен 3. Укажите продукты взаимодействия между пентан-2,3-диолом и йодной кислотой: a) пропионовый альдегид и формальдегид b) пропионовый альдегид и уксусный альдегид с) уксусный альдегид d) пропановая кислота и углекислый газ 4. Выберите апротонный растворитель: a) метанол b) ацетон c) уксусная кислота d) вода 5. Укажите конфигурацию продукта реакции (S)-пентанола-2 с п-толуолсульфохлоридом: a) S b) R c) S + R 6. Основным продуктом реакции 2-бутанола с серной кислотой при нагревании является: a) 1-бутен b) трет-бутанол c) бутадиен d) 2-бутен 7. Укажите структуру конечного продукта, полученного по следующей схеме: a) 2-метилбутандиол-2,3; b) 2-метил-3-хлорбутен-2 c) 2-метил-3-хлорбутанол-2; d) 2,2,3-триметилоксиран
9. Какие спирты образуются при восстановлении водородом следующих соединений: а) пропионового альдегида; б) метилэтилкетона; в) 2-метилпропаналя?
a. С2Н6 ® С4Н10 ® С4Н8 ® С4H9OH ® С4H8O Напишите уравнения реакций.
а) б) в) Для соединения а) напишите R-, S-конфигурацию. 14. При окислении двухатомного спирта получены триметилуксусная кислота и метилизопропилкетон. Напишите структурную формулу спирта. Назовите его по номенклатуре. 15. Какие спирты образуются в результате щелочного гидролиза: а) иодистого втор- бутила; б) 1-иод-4-метилпентана; в) 3-хлорбутена-1; г) 2,3-дибромбутана? Назовите спирты. 16. Какой из атомов галогена легче замещается на группу ОН в реакциях нуклеофильного замещения в соединениях: 2-метил-1,2-дихлорбутан; 1,3-дибромпентан; 1-иод-4-хлорбутан; 1,4-дихлорбутен-1; 3,4-дибромпентен-1; 2,3-дихлорпентадиен-1,4?
Структура белка Трехмерная структура белка формируется в процессе фолдинга (от англ. folding - «сворачивание»). Трехмерная структура формируется в результате взаимодействия структур более низких уровней. Выделяют четыре уровня структуры белка: Первичная структура — последовательность аминокислот в полипептидной цепи. Вторичная структура — это размещение в пространстве отдельных участков полипептидной цепи. Ниже приведены самые распространенные типы вторичной структуры белков: α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм (на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 аминокислотных остатка. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушают структуру α-спирали. β-складчатые слои — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удаленными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-складчатых слоев важны небольшие размеры боковых групп аминокислот, обычно преобладают глицин и аланин.
Укладка белка в виде β-складчатого слоя Неупорядоченные структуры - это неупорядоченное расположение белковой цепи в пространстве. Пространственная структура каждого белка индивидуальна и определяется его первичной структурой. Однако сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой белков. Супервторичная структура формируется за счёт межрадикальных взаимодействий. Определённые характерные сочетания α-спиралей и β-структур часто обозначают как "структурные мотивы". Они имеют специфические названия: "α-спираль-поворот-α-спираль", "структура α/β-бочонка", "лейциновая застёжка-молния", "цинковый палец" и др. Третичная структура – это способ размещения в пространстве всей полипептидной цепи. Наряду с α-спиралями, β-складчатыми слоями и супервторичными структурами в третичной структуре обнаруживается неупорядоченная конформация, которая может занимать значительную часть молекулы.
Схематичное представление укладки белка в третичную структуру. Четвертичная структура возникает у белков, которые состоят из нескольких полипептидных цепей (субъединиц, протомеров или мономеров), при объединении третичных структур этих субъдиниц. Например, молекула гемоглобина состоит из 4 субъединиц. Четвертичную структуру имеют надмолекулярные образования – мультиферментные комплексы, которые состоят из нескольких молекул ферментов и коферментов (пируватдегидрогеназа), и изоферменты (лактатдегидрогеназа - ЛДГ, креатинфосфокиназа –КФК). Итак. Пространственная структура зависит не от длины полипептидной цепи, а от последовательности аминокислотных остатков, специфичной для каждого белка, а также от боковых радикалов, свойственных соответствующим аминокислотам. Пространственную трехмерную структуру или конформацию белковых макромолекул образуют в первую очередь водородные связи, гидрофобные взаимодействия между неполярными боковыми радикалами аминокислот, ионные взаимодействия между противоположно заряженными боковыми группами аминокислотных остатков. Водородные связи играют огромную роль в формировании и поддержании пространственной структуры белковой макромолекулы. Что касается гидрофобных взаимодействий, то они возникают в результате контакта между неполярными радикалами, неспособными разорвать водородные связи между молекулами воды, которая вытесняется на поверхность белковой глобулы. По мере синтеза белка неполярные химические группировки собираются внутри глобулы, а полярные вытесняются на ее поверхность. Таким образом, белковая молекула может быть нейтральной, заряженной положительно или же отрицательно в зависимости от рН растворителя и ионогенных групп в белке. Кроме того, конформация белков поддерживается ковалентными связями S—S, образующимися между двумя остатками цистеина. В результате образования нативной структуры белка многие атомы, находящиеся на удаленных участках полипептидной цепи, сближаются и, воздействуя друг на друга, приобретают новые свойства, отсутствующие у индивидуальных аминокислот или небольших полипептидов. Важно понимать, что фолдинг — сворачивание белков (и других биомакромолекул) из развёрнутой конформации в «нативную» форму — физико-химический процесс, в результате которого белки в своей естественной «среде обитания» (растворе, цитоплазме или мембране) приобретают характерные только для них пространственную укладку и функции. В клетках имеется ряд каталитически неактивных белков, которые тем не менее вносят большой вклад в образование пространственных структур белков. Это так называемые шапероны. Шапероны помогают правильной сборке трехмерной белковой конформации путем образования обратимых нековалентных комплексов с частично свернутой полипептидной цепью, одновременно ингибируя неправильно образованные связи, ведущие к формированию функционально неактивных белковых структур. В перечень функций, свойственных шаперонам, входит защита расплавленных (частично свернутых) глобул от агрегации, а также перенос новосинтезированных белков в различные локусы клеток. Шапероны преимущественно являются белками теплового шока, синтез которых резко усиливается при стрессовом температурном воздействии, поэтому их называют еще hsp (heat shock proteins). Семейства этих белков найдены в микробных, растительных и животных клетках. Классификация шаперонов основана на их молекулярной массе, которая варьирует от 10 до 90 kDa. Они являются белками-помощниками процессов образования трехмерной структуры белков. Шапероны удерживают новосинтезированную полипептидную цепь в развернутом состоянии, не давая ей свернуться в отличную от нативной форму, и обеспечивают условия для единственно правильной, нативной структуры белка. В процессе фолдинга белка некоторые конформации молекулы забраковываются на стадии расплавленной глобулы. Деградацию таких молекул инициирует белок убиквитин. Деградация белка по убиквитиновому пути включает две основные стадии: 1) ковалентное присоединение убиквитина к подлежащему деградации белку через остаток лизина, наличие такой метки в белке является первичным сигналом сортировки, направляющей образовавшиеся конъюгаты к протеасомам, в большинстве случаев к белку присоединяется несколько молекул убиквитина, которые организованы в виде бусинок на нитке.; 2) гидролиз белка протеосомой (основная функция протеасомы – протеолитическая деградация ненужных и повреждённых белков до коротких пептидов). Убиквитин заслуженно называют «меткой смерти» для белка. Система убиквитинилирования вовлечена в такие важные процессы, как пролиферация, развитие и дифференцировка клеток, реакция на стресс и патогены, репарация ДНК. Доме́н белка́ – элемент третичной структуры белка, представляющий собой достаточно стабильную и независимую подструктуру белка, чей фолдинг проходит независимо от остальных частей. В состав домена обычно входит несколько элементов вторичной структуры. Сходные по структуре домены встречаются не только в родственных белках (например, в гемоглобинах разных животных), но и в совершенно разных белках. Белок может иметь несколько доменов, эти участки могут выполнять разные функции в одном и том же белке. Доменную структуру имеют некоторые ферменты и все иммуноглобулины. Белки с длинными полипептидными цепями (более 200 аминокислотных остатков) часто создают доменные структуры.
|





 Участие водородных связей в формировании вторичной структуры
Участие водородных связей в формировании вторичной структуры
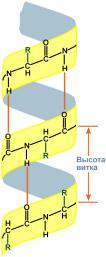 Укладка белка в виде α-спирали
Укладка белка в виде α-спирали





