Пространственное строение органических молекул
План 1. Структурная изомерия. Таутомерия 2. Стереоизомерия а) оптическая б) геометрическая в) конформационная
1. Структурная изомерия и её виды Ответить на «наивный» вопрос: что такое строение химического соединения и как его можно описать не так просто, как кажется на первый взгляд. Ответ обязательно будет неполным. Начнём с конца: строение химического соединения можно описать с помощью формулы. Первыми химикам стали известны брутто-формулы (XVIII – XIXв.в.), содержащие информацию о том, атомы каких элементов и в каком количестве входят в молекулу данного соединения: а) С4Н10 – бутан; 2) С2Н6О – этиловый спирт; 3) С4Н10О – бутиловый спирт.
Это пример изомерии углеродного скелета
Изомерия положения функциональной группы
Все эти изомеры отличаются разным порядком связывания атомов и их называют структурными изомерами. В одном из определений изомерами называют «вещества, имеющие одинаковый молекулярный состав, но разные свойства. Вещества, которые можно поместить в разные склянки». Но чем дальше развивается химическая наука, тем менее полным является это определение. При обычных условиях превращение изомеров друг в друга отсутствует. Структурной изомерии родственно явление таутомерии (подвижной изомерии), которое имеет исключительное значение в процессах жизнедеятельности. Таутомерия – это подвижное равновесие между взаимопревращающимися друг в друга структурными изомерами – таутомерами. Таутомерия связана с переносом какого-либо атома, чаще всего протона (прототропная таутомерия). К ней относится
кето-енольная таутомерия
лактим-лактамная таутомерия
енамино-иминная
Очень распространённым видом таутомерии в химии моносахаридов является цикло-оксо-таутомерия, т.е. равновесие между циклической и открытой, цепной формой моносахарида.
2. Стереоизомерия Не успели химики привыкнуть к структурным формулам, как появились новые проблемы, связанные с существованием «лишних» изомеров, которые имели и одинаковый состав и одинаковую структурную формулу, а по свойствам тем не менее различались. Поиск причины этих различий привёл к появлению пространственных представлений о строении химических соединений и созданию стереохимии. Моментом её рождения можно считать 1874 г, когда 22-летний швед Я. Вант-Гофф и 27-летний француз Ле-Бель независимо друг от друга выдвинули гипотезу о тетраэдрическом строении насыщенного атома углерода и, исходя из этого, сформулировали теорию пространственного строения органических соединений. Ход рассуждений Вант-Гоффа помогает понять эту теорию. У насыщенного атома углерода все четыре связи совершенно одинаковы. Это может быть только в двух случаях: 1) если все четыре заместителя расположены по углам квадрата, в центре которого находится атом углерода (плоская модель) или 2) если все заместители находятся в вершинах тетраэдра, а атом углерода в его центре (тетраэдрическая модель) Выбор между ними можно сделать, рассмотрев число возможных изомеров для метана. Для монозамещённых производных CH3R обе модели допускают существование только одного изомера. Для дизамещённых производныхCH2R1R2 для плоской модели должны существовать два изомера, для тетраэдрической – один
Справедливость выбора тетраэдрической модели строения атома углерода следовала из практики: двузамещённые производные метана имели один изомер, а три- и тетразамещённые – по два изомера. Эти два изомера CHR1R2R3 называются пространственными изомерами или стереоизомерами. На первый взгляд эти изомеры ничем не отличаются. Но как только мы попытаемся наложить друг на друга центральные атомы углерода и два любых заместителя, два оставшихся заместителя не совпадут. Эти два изомера относятся друг к другу как предмет и несовместимое с ним зеркальное изображение, как правая и левая рука, как пара перчаток или ботинок.
Простейший случай появления у молекулы хиральности мы уже рассмотрели – это наличие насыщенного атома углерода (sp3-гибридизированного), содержащего четыре разных заместителя. Такой атом принято называть ассиметричным и обозначать С*. Энантиомеры имеют одинаковые физические и химические свойства: одинаковые температуры кипения и плавления, с одинаковой скоростью вступают в одни и те же реакции. Отличить их можно только одним способом: если через их растворы пропустить пучок плоскополяризованного света, то один изомер повернёт плоскость поляризации влево (-), а другой – на такой же угол вправо (+), т.е. энантиомеры обладают оптической активностью, отсюда их первое название – оптические изомеры. Примерами молекул, обладающих оптической активностью и имеющих зеркальные изомеры, являются CHFClBr, молочная кислота, аминокислота аланин. Смесь равных количеств энантиомеров называется рацемической (±). Рацемат не обладает оптической активностью, т.к. происходит компенсация знака вращения.
1. Заместители в плоскости изображают сплошными линиями. 2. Заместители, выходящие из плоскости к зрителю, зачернённым клином. 3. Заместители, уходящие за плоскость – пунктирной линией.
При написании формул часто встречающихся оптически активных окси- и аминокислот придерживаются следующих правил: 1. Ассиметрический атом углерода (С*) изображают пересечением двух прямых, на концах которых находятся четыре разных заместителя. 2. Углеродная цепь располагается вертикально. 3. Сверху располагается наиболее старшая группа 4. Атомы водорода и функциональные группы с гетероатомом изображаются у горизонтальных концов 5. Формула с функциональной группой, находящейся справа, соответствует Д-изомеру, слева – L-изомеру.
Между отнесением молекул к Д и L-ряду и знаком оптического вращения никакой связи не существует. Знак вращения можно определить только экспериментально. Вопрос об абсолютной конфигурации оптически активных соединений, т.е. о действительном расположении групп в пространстве, долгое время не был решен. Условно было принято сравнивать структуру оптических изомеров с конфигурацией оптического стандарта – глицеринового альдегида.
Его абсолютная конфигурация была установлена с помощью рентгеноструктурного анализа. Оптически активные соединения, конфигурацию которого надо установить, превращают в глицериновый альдегид с помощью ряда химических реакций, не затрагивающих хиральный центр. В зависимости от того, какой глицериновый альдегид получают Д- или L-, такова и абсолютная конфигурация исходного изомера. Так было установлено, что левовращающая молочная кислота брожения относится к Д-ряду, а правовращающая мясомолочная кислота – к L-ряду, т.е. не всегда отношение к Д- или L-ряду совпадает с правым или левым вращением плоскости поляризации.
Этот атом углерода является ассиметрическим. В молекуле аминокислоты могут быть и другие хиральные центры, но именно конфигурация этого атома углерода сравнивается с глицериновым альдегидом и определяет принадлежность α-аминокислоты к Д или L-ряду. Все природные аминокислоты относятся к L-ряду.
Если в молекуле вещества имеется несколько ассиметрических атомов углерода, в количестве n, то такая молекула существует в видеN = 2n стереоизомеров. Так, Д-глюкоза, изображенная с помощью формулы Фишера (I), имеет 4 ассиметрических атомов углерода. Для нее можно изобразить 16 (24) фомул стереоизомеров. Её зеркальный изомер (энантиомер) L-глюкоза (II) отличается от Д-глюкозы конфигурацией всех хиральных центров. Это два разных вещества  
Стереоизомеры могут отличаться конфигурацией только одного ассиметрического атома углерода – это эпимеры. Так, Д-манноза (III) – это эпимер Д-глюкозы по С-2. Д-маннозе соотвествует зеркальный стереоизомер L-манноза (IV). Другие стереоизомеры, отличающиеся конфигурацией более, чем одного хирального центра, называются диастереомерами (соединения II и III). Следовательно, 16 стереоизомеров образуют 8 пар энантиомеров. Для определения принадлежности моносахарида к Д- или L-ряду принято сравнивать конфигурацию его ассиметрического атома углерода, имеющего наибольший номер, с конфигурацией ассиметрического атома углерода глицеринового альдегида – конфигурационного стандарта. Практически все природные моносахариды являются Д-изомерами.
Химические вещества, имеющие хиральный центр, при получении их синтетическим путём in vitro, не обладают оптической активностью, т.к. в этих условиях образуется рацемат, т.е. равная смесь энантиомеров. В живом организме эти же реакции протекают стереоселективно, т.е. с образованием только одного оптического изомера. Причина этого в том, что реакции in vivo протекают с участием ферментов. А ферменты – это белковые вещества, построенные из хиральных молекул α-аминокислот. Если в синтезе участвует оптически активный реагент, то и продукт реакции тоже будет обладать оптической активностью. Такой ассиметрический синтез проводят в настоящее время и вне организма для получения лекарственных препаратов, т.к. среди лекарственных препаратов очень часто встречаются случаи, когда только один энантиомер обладает биологическим действием, а второй совершенно неактивен. Конфигурацию биологически активного энантиомера наиболее точно соответствует конфигурации активного центра рецептора клетки и он прочнее связывается с ним. Кроме ассиметрического синтеза для получения одного из энантиомеров используют обычный синтез, когда образуется рацемат, но затем его разделяют на оптические изомеры физическим, биологическим или химическим (с помощью вспомогательных оптически активных веществ) методом. Для превращения двух энантиомеров, обязанных своей хиральностью наличием ассиметрического атома углерода, нужно или разорвать одну из связей или очень существенно деформировать углеродный тетраэдр (выворачивание зонтика ветром). И в том, и в другом случае затраты энергии достаточно велики, поэтому энантиомеры обычно стабильны.
Геометрическая (цис-транс-) изомерия Этот вид пространственной изомерии существует в соединениях с кратными связями, в которых заместители при каждом атоме углерода двойной связи попарно различны. Классическим примером цис-транс-изомерии являются малеиновая и природная фумаровая кислоты.
Эти два изомера отличаются расположением заместителей в пространстве относительно π-электронного облака двойной связи
Эти стереоизомеры нельзя совместить в пространстве, хотя они и не являются зеркальными антиподами. Такие изомеры называются диастереомерами. В отличие от энантиомеров они обладают различными физическими и химическими свойствами. Например, природная фумаровая кислота имеет температуру плавления 287°С, а искусственная малеиновая имеет более низкую температуру плавления 130°С. Для перехода одного изомера в другой требуется разрыв π-связи, а это требует затрат энергии (обычно сотен килоджоулей на моль), т.е. при нагревании или УФ-облучении. Геометрическая изомерия может быть связана с различным положением заместителей относительно плоскости какого-либо цикла (обычно трёх-четырёхчленных).
Конформационная (поворотная) изомерия Это ещё один вид стереоизомерии. Ещё в середине XIXв. стало ясно, что внутри молекул возможно вращение вокруг одинарных σ-связей и что вращение происходит быстро. Причём это вращение не совсем свободно и возможны более или менее предпочтительные формы молекул в зависимости от того, как меняется взаимная ориентация групп при повороте вокруг оси простой связи. Но в XIXв. не было такого инструмента, чтобы обнаружить такие изомеры вращения. И только в 30е годы XXв. физики-спектроскописты получили доказательства существования таких поворотных изомеров, которые трудно выделить. Изучая колебательные спектры (точнее, спектры комбинационного рассеяния) 1,2-дихлорэтана в зависимости от температуры, учёные обнаружили, что в твёрдом дихлорэтане всегда меньше линий, чем в жидком и газообразном. Они предположили, что у твёрдого дихлорэтана имеется устойчивая транс-форма, а с повышением температуры за счёт вращения появляется менее выгодная цис-форма. Впоследствии оказалось, что новые линии принадлежат не цис-форме, а более выгодной скошенной (или гош-)форме
Пространственные формы, которые возникают при вращении групп атомов вокруг простой σ-связи как вокруг оси называют поворотными изомерами или конформациями. Среди рассмотренных конформаций энергетически выгодной является транс (анти)-форма. Её называют заторможенной конформацией. Затем идёт скошенная (гош-) конформация и менее выгодная заслонённая (цис-конформация). Разница в энергиях очень небольшая и поэтому взаимные переходы происходят легко и такие поворотные изомеры в обычных условиях в индивидуальном виде выделить невозможно.
В длинных углеводородных цепях вращение может происходить вокруг нескольких углерод-углеродных связей и вся цепь может принимать разнообразные конформации
Зигзагообразная конформация – наиболее выгодная анти-конформация
Поворотная изомерия существует и для алициклических соединений. Это особенно важно для циклогексана. В правильном плоском кольце циклогексана должно существовать сильное угловое напряжение (угол должен быть 120° вместо 109°28/ для углерода в sp3-гибридизации). Напряжение в кольце можно снять, изогнув это кольцо в пространстве, причём только двумя способами. Эти ненапражённые изомеры циклогексана сейчас называют «креслом» и «ванной».
Из этих двух конформаций энергетически более выгодна конформация кресла. Скорость их взаимопревращений высока, поэтому выделить их невозможно при нормальных условиях. Заместители в циклогексане могут занимать аксиальное (связи параллельны оси молекулы) или экваториальное положение.
Конформации шестичленного цикла приобретают особое значение в химии углеводов, т.к. тетрагидропирановый (пиранозный) цикл является структурной единицей моносахаридов.
Многие необычные свойства глюкозы и других углеводов можно понять, анализируя их конформационное строение. Таким образом, по определению Берцелиуса изомеры – это соединения с одинаковым качественным и количественным составом, но отличающиеся последовательностью связывания атомов в молекуле или расположением их в пространстве
|



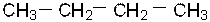
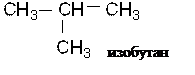
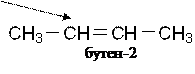












 Причиной прототропной таутомерии ялвяется возможность стабилизации аниона (образовавшегося после отщепления Н+) за счёт сопряжения. Возвращение Н+ может происходить как на «старое» место, так и по другому концу сопряжённой системы с перемещением двойной связи.
Причиной прототропной таутомерии ялвяется возможность стабилизации аниона (образовавшегося после отщепления Н+) за счёт сопряжения. Возвращение Н+ может происходить как на «старое» место, так и по другому концу сопряжённой системы с перемещением двойной связи.



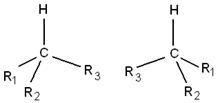 Для тризамещённых соединений CHR1R2R3 в плоской модели можно изобразить 3 изомера, в тетраэдрической – два.
Для тризамещённых соединений CHR1R2R3 в плоской модели можно изобразить 3 изомера, в тетраэдрической – два.
 Такое свойство объекта, заключающееся в невозможности его совмещения с зеркальным изображением путём перемещения или вращений называется хиральностью (греч. heir хайр - рука). Любая хиральная молекула должна иметь пару – зеркальный антипод. Поэтому эти изомеры называют зеркальными изомерами (антиподами) или энантиомерами.
Такое свойство объекта, заключающееся в невозможности его совмещения с зеркальным изображением путём перемещения или вращений называется хиральностью (греч. heir хайр - рука). Любая хиральная молекула должна иметь пару – зеркальный антипод. Поэтому эти изомеры называют зеркальными изомерами (антиподами) или энантиомерами.
 Для изображения стереоизомеров на плоскости потребовались формулы, отражающие их пространственное строение. Для этого используют стереохимические формулы
Для изображения стереоизомеров на плоскости потребовались формулы, отражающие их пространственное строение. Для этого используют стереохимические формулы





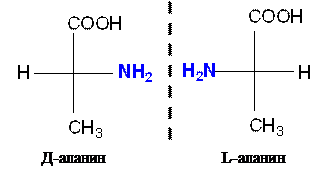




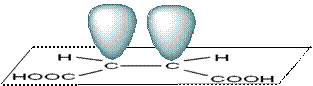











 Клешневидная конформация. В ней облегчается пространственное взаимодействие функциональных групп у 1 и 5 (или 6) атомов. При этом могут образоваться устойчивые пяти- или шестичленные циклы
Клешневидная конформация. В ней облегчается пространственное взаимодействие функциональных групп у 1 и 5 (или 6) атомов. При этом могут образоваться устойчивые пяти- или шестичленные циклы





 Энергетически предпочтительной является экваториальная ориентация заместителя, т.к. в этом случае он находится в заторможенной или анти-конформации.
Энергетически предпочтительной является экваториальная ориентация заместителя, т.к. в этом случае он находится в заторможенной или анти-конформации.




