Пример 6
К 100 мл 0,5 М раствора НСООNa прилили 440 мл 0,1 Мраствора НСООН. Рассчитать буферную емкость по кислоте и по основанию для образовавшегося раствора с рН=3,8. Решение Рассчитаем буферную емкость по кислоте, то есть, сколько моль эквивалентов соляной кислоты нужно прибавить к 1 л буфера, чтобы понизить его рН на единицу.
Вычислим концентрации муравьиной кислоты и формиата натрия в буферном растворе.
Пусть х – число моль эквивалентов соляной кислоты, прибавленных к одномулитру буфера для уменьшения рН на единицу, то есть буферная емкость. При добавлении соляной кислоты протекает реакция: HCOONa + HCl = HCOOH + NaCl Тогда концентрация муравьиной кислоты возрастет на х моль/л и станет равной (0,0018+ х) моль/л, а концентрация формиата натрия уменьшится на х моль/л и станет равной (0,0014 – х) моль/л, при этом рН понизится до 2,8. С учетом уравнения (2.6.1), запишем:
Из данного выражения можно найти буферную емкость, обозначенную переменной х. Буферная емкость по кислоте равна 0,075 моль/л. Рассчитаем буферную емкость по основанию. Пусть у – буферная емкость по основанию. При добавлении основания протекает реакция: HCOOH + NaOH = HCOONa + H2O Тогда при добавлении гидроксида натрия концентрация муравьиной кислоты уменьшится на у моль/л, а концентрация формиата натрия увеличится на у моль/л, при этом водородный показатель буфера возрастет на единицу и станет равным 4,8. В соответствии с уравнением (2.6.1), запишем:
Решая это уравнение относительно у, получаем у= 0,067 моль/л. Итак, буферная емкость по основанию равна 0,067 моль/л.
|



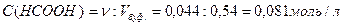

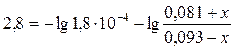 .
.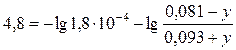 .
.


