Пример 2. Вычислите рН 0,01 М раствора аммиака.
Вычислите рН 0,01 М раствора аммиака. Решение При расчете водородного показателя среды водных растворов слабых кислот и оснований следует учитывать обратимость процесса их электролитической диссоциации (α;<1). NH3·H2O ⇆ NH4+ +OH– Концентрация ионов H+ в растворах слабых кислот и концентрация ионов ОН– в растворах слабых оснований численно равны концентрации продиссоциировавших молекул электролита, а не исходной концентрации раствора, как в случае сильных кислот и оснований. Концентрацию продиссоциировавших на ионы молекул электролита определяют, исходя из степени диссоциации: С=αСо, где Со - исходная концентрация молекул, моль/л. Степень диссоциации рассчитывают на основании закона разбавления Оствальда, при этом константы диссоциации слабых электролитов берут из справочной литературы. В случаях, когда расчет по упрощенному уравнению (2.5.2) дает результат α>;0,1, вычисления повторяют по более точной формуле (2.5.1). При вычислении водородного или гидроксильного показателя среды раствора слабой кислоты или слабого основания можно приближенно считать, что вследствие малых ионных сил растворов, активности ионов равны их молярным концентрациям. Степень диссоциации NH3·Н2О в 0,01 М растворе равна:
Находим концентрацию молекул NH3·Н2О, распавшихся на ионы, и равную ей концентрацию ионов ОН -: С=α·Со = 4,2 10-2 ·10-2 = 4,2·10-4 моль/л, CОН- = = 4,2·10-4 моль/л. Определяем рОН и рН 0,01 М раствора аммиака: рОН = -lg СОН- = -lg 4,2·10-4 = 3,33 рН = 14 - 3,33 = 10,67.
|

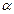 =
= 




