Лекция № 3. Тема 2.1.1 Статистический и термодинамический методы исследования
Тема 2.1.1 Статистический и термодинамический методы исследования. Идеальный газ. Уравнения молекулярно-кинетической теории идеального газа для давления. Молекулярно-кинетическая трактовка абсолютной температуры.
План 1 Статистический и термодинамический методы исследования. 2 Идеальный газ. Уравнения молекулярно-кинетической теории идеального газа для давления. 3 Средняя кинетическая энергия молекул. Молекулярно-кинетическая трактовка абсолютной температуры.
Литература: [1] Чолпан П.П. Фізика: Підручник. – К.: Вища шк., 2004. – 567 с. (§ 4.1 - § 4.4)
[2] За редакцією І.Є. Лопатинського. Зачек І.Р., Кравчук І.М., Романишин Б.М. та ін. Курс фізики: Навчальний підручник. – Львів: Видавництво «Бескид Біт», 2002 р. – 367 с. (§28-§30)
1 Молекулярная физика и термодинамика – разделы физики, в которых изучаются макроскопические процессы в телах, связанные с большим количеством атомов и молекул, из которых состоят тела. Для исследования этих процессов используются два метода: статистический (молекулярно-кинетический) и термодинамический. Молекулярная физика изучает строение и свойства вещества исходя из молекулярно-кинетических представлений о том, что все тела состоят из атомов и молекул, которые пребывают в непрерывном тепловом движении. Свойства огромного скопления молекул, которые образуют тело, подлежат особым статистическим закономерностям и их можно изучить с помощью статистического метода, который основывается на том, что свойства макроскопической системы определяются свойствами их движения и усредненными значениями динамических характеристик этих частиц (скорости, энергии и т.д.). Термодинамика – раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. На основании термодинамического метода изучаются условия превращения энергии из одного вида в другой и те же превращения с количественной стороны. В основе термодинамики лежат два экспериментально установленных закона, которые называют первым и вторым законами термодинамики. Термодинамическая система – совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией, как между собой, так и с другими телами. Состояние системы задается термодинамическими параметрами – совокупностью физических величин, характеризующих свойства термодинамической системы. Состояние термодинамической системы называется стационарным, если значения всех термодинамических параметров системы не изменяется со временем. Какое-либо изменение в термодинамической системе, которое связано с изменением хотя бы одного из его термодинамических параметров, называется термодинамическим процессом.
2 Под идеальным газом понимают такой газ, в котором частицы между собой на расстоянии не взаимодействуют, а размерами их можно пренебрегать, то есть считать, что масса их сосредоточена в точке. Уравнение, которое связывает для определенной массы вещества объем, давление и температуру, называют термическим уравнением состояния вещества. Важнейшие параметры состояния химически однородной системы – объем V, давление р и температура Т. Между этими тремя основными параметрами состояния существует связь, называемая уравнением состояния:
В молекулярно-кинетической теории пользуются моделью идеального газа, удовлетворяющей такие условия: 1) собственный объем молекул газа ничтожно мал сравнительно с объемом сосуда; 2) между молекулами газа отсутствуют силы взаимодействия; 3) столкновения молекул газа между собой и со стенками сосуда абсолютно упруги. Основное уравнение молекулярно-кинетической теории идеального газа для давления:
или
где Для одного моля газа m=μ и V= Vm
Тогда pVm = (1/3)μυ2ср.кв.
Уравнение Менделеева-Клапейрона для 1 моля р Vm= RT
Из уравнения Менделеева-Клапейрона
На рисунке изображена зависимость <εк> от Т. Если Т = 0, < εк > = 0, то есть прекращается поступательное движение молекул газа, а значит, равно нулю и его давление. Абсолютная температура является мерой средней кинетической энергии поступательного движения молекул. Однако в области температур, близких к абсолютному нулю, поведение молекул описывается не классическими законами, а законами квантовой механики.
Контрольные вопросы 1 Что такое термодинамика? 2 Что изучают с помощью статистического метода? 3 Что такое термодинамический процесс? 4 Что понимают под идеальным газом? 5 Назовите важнейшие параметры состояния химически однородной системы. 6 Что называется уравнением состояния? 7 От чего зависит средняя кинетическая энергия поступательного движения молекул идеального газа? Содержательный модуль 2.1 Законы идеального газа
Тема 2.1.2 Законы идеального газа для изопроцессов. (Самостоятельное изучение)
План 1 Изопроцессы. Газовые законы. 2 Изотермический процесс. 3 Изобарный процесс. 4 Изохорный процесс.
Литература: [3] Дмитрієва В.Ф. Фізика: Навчальний посібник для студентів навчальних закладів І-ІІ рівнів акредитації. – К: Техніка, 2008. – 648 с. (§ 46)
|

 f = (V, р, Т) = 0
f = (V, р, Т) = 0
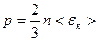
 – средняя кинетическая энергия поступательного движения одной молекулы газа.
– средняя кинетическая энергия поступательного движения одной молекулы газа.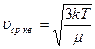

 3 Средняя кинетическая энергия поступательного движения молекул идеального газа зависит только от его абсолютной температуры <εк> прямо пропорциональна к Т.
3 Средняя кинетическая энергия поступательного движения молекул идеального газа зависит только от его абсолютной температуры <εк> прямо пропорциональна к Т.


